-
(2014•长宁区一模)①②③④甲种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A. 已知H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B. 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g) =2H2(g)+O2(g)ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2 800 kJ·mol-1,则1/2C6H12O6(s)+3O2(g) =3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
难度: 中等查看答案及解析
-
铜锌原电池装置(见图),下列分析正确的是( )
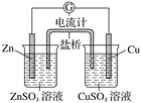
A. 一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小
B. 原电池工作时,Cu电极流出电子,发生反应:Cu-2e-===Cu2+
C. 原电池工作时,Zn电极发生还原反应:Zn2++2e-===Zn
D. 原电池工作时的总反应为Zn+Cu2+===Zn2++Cu
难度: 中等查看答案及解析
-
对于可逆反应H2(g)+I2(g)
2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是( )
A. H2(g)的消耗速率与HI(g)的生成速率之比为2∶1
B. 反应进行的净速率是正、逆反应速率之差
C. 正、逆反应速率的比值是恒定的
D. 达到平衡时,不同物质表示的正、逆反应速率一定相等
难度: 简单查看答案及解析
-
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
A. AgCl不溶于水,不能转化为AgI
B. 在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C. AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D. 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
×10-11 mol·L-1
难度: 困难查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e— +2OH—= Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO42-+ 4H2O
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
难度: 简单查看答案及解析
-
稀氨水中存在着下列平衡:NH3·H2O
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
难度: 中等查看答案及解析
-
为了除去氯化镁酸性溶液中的Fe3+,可在加热搅拌条件下加入下列试剂中的( )
A. NH3·H2O B. NaOH C. Na2CO3 D. MgCO3
难度: 简单查看答案及解析
-
下列有关叙述中正确的是( )
A. 滴定管下端连有橡皮管的为酸式滴定管
B. 在滴定时,左手操作锥形瓶,右手操作滴定管开关
C. 滴定前应首先排除尖嘴部分的气泡
D. 滴定过程中两眼应注视滴定管内液面的变化
难度: 简单查看答案及解析
-
某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的氢氧化钠溶液中,由水电离出的c(H+)=10-11mol·L-1。在相同温度下,0.1mol·L-1氢氧化钠溶液的pH应为( )
A. 13 B. 12 C. 11 D. 10
难度: 困难查看答案及解析
-
在由水电离出的c(H+)=1×10-12mol·L-1的溶液中,一定能大量共存的离子组是
A. NH4+、Ba2+、NO3-、Cl- B. Cl-、NO3-、Na+、K+
C. SO42-、NO3-、Fe2+、Mg2+ D. Na+、K+、ClO-、I-
难度: 中等查看答案及解析
-
将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系式正确的是( )
A. c(Cl-)>c(NH4+)>c(OH-)>c(H+) B. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c(Cl-)=c(NH4+>c(H+)=c(OH-) D. c(NH4+)>c(Cl-)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
甲醇、氧气和强碱溶液作电解质的手机电池中的反应为2CH3OH+3O2+40H-
2CO32-+6H2O,有关说法正确的是
A. 放电时,CH3OH 参与反应的电极为正极
B. 放电时,负极电极反应:CH3OH+8OH--6e-=CO32-+6H2O
C. 标准状况下,通入的11.2LO2完全反应有1mol电子转移
D. 充电时电解质溶液的pH逐渐减小
难度: 中等查看答案及解析
-
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
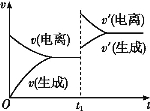
A.加少量烧碱溶液 B.升高温度 C.加少量冰醋酸 D.加水
难度: 中等查看答案及解析
-
下图是研究铁钉腐蚀的装置图,下列说法不正确的是
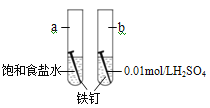
A. 铁钉在两处的腐蚀速率:a < b
B. a、b两处铁钉中碳均正极
C. a、b两处铁钉中的铁均失电子被氧化
D. a、b两处的正极反应式均为O2+4e-+4H+===2H2O
难度: 简单查看答案及解析
-
A. 酸式滴定管需用待测盐酸润洗
B. 碱式滴定管不用标准碱液润洗
C. 滴定过程中不能有液体从锥形瓶溅出
D. 滴定结束,读数时要平视读数
难度: 中等查看答案及解析
-
已知25℃时,合成氨反应N2(g)+3H2(g)
2NH3(g)ΔH=−92.0 kJ·mol−1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为23 kJ(假定测量过程中没有能量损失),则N2的转化率为(()
A. 25% B. 50% C. 75% D. 无法确定
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ
D. 已知2C(s)+2O2(g)===2CO2(g) ΔH1,2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1<ΔH2
难度: 中等查看答案及解析
