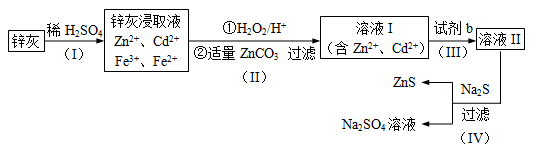
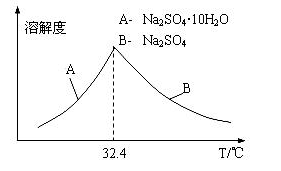
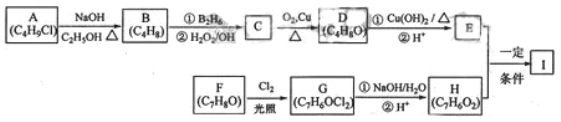
-
化学与社会、生活密切相关。对下列现象或事实的解释不正确的是(
)
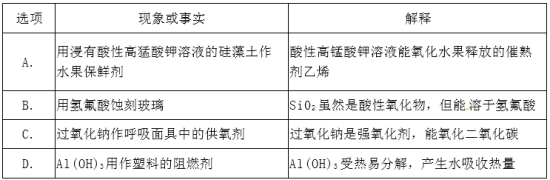
难度: 简单查看答案及解析
-
已知某药物具有抗痉挛作用,制备该药物其中一步反应为:
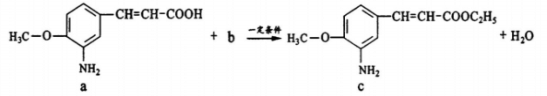
下列说法不正确的是
A.a中参加反应的官能团是羧基
B.生活中b可作燃料和溶剂
C.c极易溶于水
D.该反应类型为取代反
应
难度: 中等查看答案及解析
-
根据下图所给信息,得出的结论正确的是( )

A.碳的燃烧热为bkJ/mol
B.2C(s)+O2(g)=2CO(g)△H=-2(b-a)kJ/mol
C.2CO2(s)=2CO(g)+O2(g)△H=+akJ/mol
D.C(s)+O2(g)=CO2(g)△H<-bkJ/mol
难度: 中等查看答案及解析
-
溶液X中含有右表离子中的某5种,且其浓度均为0.1mol/L(不考虑水的电离与离子水解)。向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化。下列叙述不正确的是( )

A.X溶液中不可能含有HC03-或CO32-
B.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+=3Fe3++NO+2H2O
C.根据电荷守恒,原溶液中一定含Mg2+
D.X溶液中一定含3种阳离子、2种阴离子
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,W与X同主族,Y的最外层电子数是电子层数的3倍,Y与W核外电子数相差6,Z的最外层电子数等于电子层数。下列说法正确的是( )
A. X、Y、W元素的原子半径依次递增
B. X、Z、W元素的最高价氧化物的水化物的酸性依次递增
C. X、W分别与Y形成化合物在常温下均为气态
D. Z、W分别与Y形成的化合物均可作为耐高温材料
难度: 中等查看答案及解析
-
常温下,向20mL的某稀H2S04溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴人氨水体积变化如图。下列分析正确的是( )
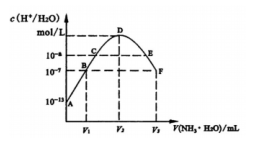
A.稀硫酸的浓度为0.1mol/L
B.C点溶液pH=14-a
C.E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D.B到D、D到F所加氨水体积一定相等
难度: 困难查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5
则下列有关比较中正确的是
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 最高正化合价:④>③=②>①
难度: 中等查看答案及解析