-
下列依据实验操作及现象得出的结论正确的是( )
选项
实验操作
现象
结论
A
向亚硫酸钠试样中滴入盐酸酸化的Ba(ClO)2 溶液
产生白色
沉淀
试样已氧化变质
B
向Co2O3中滴入浓盐酸
产生黄绿色
气体
氧化性: Co2O3>Cl2
C
向待测液中依次滴入氯水和KSCN溶液
溶液变为
红色溶液
待测液中含有Fe2+
D
向Na2SO4和Na2CO3混合溶液中滴入AgNO3 溶液
产生白色
浑浊
Ksp(Ag2SO4)<Ksp(Ag2CO3)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于硫的叙述中不正确的是( )
A. 在自然界中既有化合态的硫又有能以游离态的形式存在的硫
B. 游离态的硫存在于火山喷口附近或地壳的岩层里
C. 实验室常用酒精除去附着在试管壁上的硫黄
D. 硫是黑火药的主要成分之一
难度: 中等查看答案及解析
-
以下有关氨及铵盐的叙述中,不正确的是( )
A. 铵态氮肥不能与碱性物质,如草木灰混合施用
B. 氨的喷泉实验体现了氨的溶解性和氧化性
C. 实验室常用固体氯化铵与氢氧化钙固体反应制取氨气
D. 氨具有还原性,一定条件下可与氧化性物质,如氧气反应
难度: 中等查看答案及解析
-
在实验室中,下列物质的保存方法不正确的是
A. 少量金属钠保存在煤油中
B. 烧碱溶液盛放在用玻璃塞塞紧的试剂瓶中
C. FeSO4溶液存放在加有少量铁粉的试剂瓶中
D. 水玻璃应密封保存防止久置在空气中而变质
难度: 简单查看答案及解析
-
下列物质按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合中,正确的是
强电解质
弱电解质
酸性氧化物
碱性氧化物
A
H2SO4
CH3COOH
NO2
Na2O
B
BaSO4
HClO
Mn2O7
CaO
C
NaCl
氨水
SO2
MnO2
D
HI
HF
CO2
Fe3O4
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 不能发生丁达尔效应的分散系有氯化钠溶液、水等
B. 将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
C. 黄河入海口处三角洲的形成与胶体性质有关
D. 电泳现象说明胶体带电
难度: 中等查看答案及解析
-
类比推理是化学中常用的思维方法。下列推理正确的是
A. Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
B. CO2与Ba(NO3)2溶液不反应,SO2与Ba(NO3)2溶液也不反应
C. CO2是直线型分子,推测CS2也是直线型分子
D. NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr
难度: 中等查看答案及解析
-
下列除杂试剂或方法有错误的是
原物质
所含杂质
除杂试剂
主要操作方法
A
HNO3溶液
H2SO4
BaCl2溶液
过滤
B
CO2
SO2
酸性KMnO4溶液、浓硫酸
洗气、干燥
C
SiO2
Al2O3
稀盐酸
过滤
D
C2H5OH
CH3COOH
CaO
蒸馏
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
2015年底联合国气候变化大会在巴黎召开,签署了《巴黎协定》。该协定要求各国采取更有效的“节能减排”措施控制温室效应。下列做法不利于“节能减排”的是( )
A. 减少使用化石燃料 B. 大力发展火力发电
C. 改变能源结构,开发使用清洁能源 D. 将煤气化或液化,以提高其综合利用率
难度: 简单查看答案及解析
-
下列有关物质制备的反应中,其原理不属于氧化还原反应的是( )
A. 制金属钛 B. 湿法炼铜 C. 实验室制O2 D. 侯氏制碱
难度: 简单查看答案及解析
-
下列物质不能通过化合反应直接制得的是
A. Fe(OH)3 B. FeCl2 C. CuS D. FeCl3
难度: 简单查看答案及解析
-
下列实验操作错误的是( )
A. 分液漏斗使用前需要先检查是否漏液
B. 实验中剩余的钠不能再放回原试剂瓶
C. 做焰色反应时,铂丝应用盐酸洗净并灼烧至无色
D. 蒸馏烧瓶加热时需要垫石棉网
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 某溶液中加入BaCl2溶液,生成白色沉淀,说明原溶液中含有SO42-
B. 能使湿润的淀粉KI试纸变蓝的物质一定是Cl2
C. 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D. 制备Fe(OH)3胶体时,向沸腾的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)
Cl2
FeCl2 B. NH3
NO
HNO3
C. Fe
Fe2O3
Fe D. S
SO3
H2SO4
难度: 中等查看答案及解析
-
下列物质与其用途完全符合的是
①Na2O2--供氧剂 ②晶体Si--太阳能电池 ③干冰--人工降雨 ④NaCl--制纯碱 ⑤Al2O3--焊接钢轨 ⑥NaClO--消毒剂 ⑦Fe2O3--红色油漆或涂料 ⑧SO2--食品防腐剂 ⑨NH3--制冷剂 ⑩水玻璃--木材防火剂
A. ①②③④⑥⑦⑨⑩ B. ①②③④⑤⑧⑨
C. ①②③⑥⑦⑨⑩ D. ①②③④⑥⑦⑨
难度: 简单查看答案及解析
-
实验室中需要配制1mol/L的H2SO4溶液980mL,应选用容量瓶的规格和量取密度为1.84g/mL,质量分数为98%的浓硫酸的体积分别是
A. 980mL,53.3mL B. 1000mL,54.30mL C. 1000mL,54.3mL D. 980mL,53.30g
难度: 中等查看答案及解析
-
下列说法正确的是
A. SiO2溶于水显酸性
B. 普通玻璃和氮化硅陶瓷分别属于传统无机非金属材料和新型无机非金属材料
C. 因为高温时SiO2与Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强
D. SiO2是酸性氧化物,它在常温时不溶于任何酸
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A. 由2H和18O所组成的水22g,其中所含的中子数为12 NA
B. 分子数为NA的N2、CO混合气体体积在标况下为22.4 L,质量为28 g
C. 标准状况下,22.4LNO和11.2L O2混合后气体的分子总数为NA
D. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
难度: 困难查看答案及解析
-
表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是 ( )
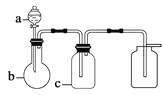
编号
气体
a
b
c
A
NH3
浓氨水
生石灰
碱石灰
B
SO2
70%浓H2SO4
Na2SO3固体
98%浓H2SO4
C
NO
稀HNO3
铜屑
H2O
D
NO2
浓HNO3
铜屑
NaOH溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质
Br2
CCl4
正十二烷
密度/g·cm-3
3.119
1.595
0.753
沸点/℃
58.76
76.8
215~217
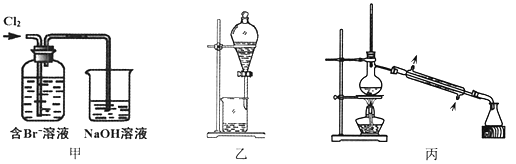
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
难度: 中等查看答案及解析
-
下列酸性H2CO3>HClO>HCO3-,下列有关叙述中正确的是
①向NaClO溶液中通入少量二氧化碳的离子反应方程式为:2ClO-+CO2+H2O=2HC1O+CO32-
②向KI和KBr混合溶液中,加入足量FeCl3溶液,用CCl 4萃取后取上层液体少许并加入AgNO3溶液,有淡黄色沉淀生成
③向FeI2溶液中滴加少量氯水。反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
④卫生间的洁厕灵不能跟84消毒液混用,其离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O
A. ②④ B. ①③ C. ②③ D. ①④
难度: 中等查看答案及解析
-
已知将Fe3O4看作为(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应的离子方程式为:3Fe2+ +2S2O32- +O2 +4OH- = Fe3O4 +S4O62- +2H2O,下列说法正确的是( )
A. O2和S2O32-是氧化剂,Fe2+ 是还原剂
B. 每生成1 mol Fe3O4,转移2 mol电子
C. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol
D. 参加反应的氧化剂与还原剂的物质的量之比为1∶5
难度: 困难查看答案及解析
-
CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是
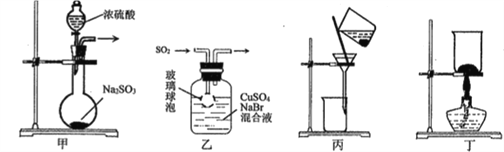
A. 用装置甲制取SO2 B. 用装置乙制取CuBr
C. 用装置丙避光将CuBr与母液分离 D. 用装置丁干燥CuBr
难度: 困难查看答案及解析
-
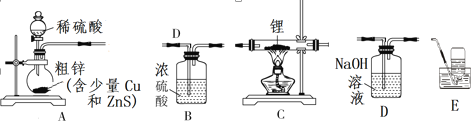
稀有金属钌(Ru)的性质很稳定,耐腐蚀。实验室用H2还原RuO2来制备金属钌的装置如图所示。下列说法错误的是
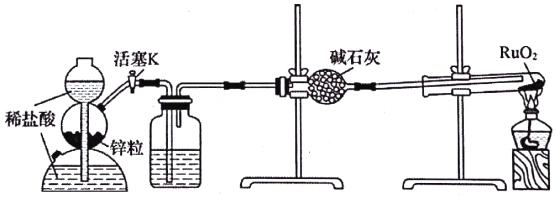
A. 加热RuO2前,应先收集气体并点燃,通过声音判断气体纯度
B. 洗气瓶中盛装的可能是NaOH溶液,用于除去挥发出来的HCl气体
C. 结束反应时,先停止加热,待试管冷却到室温后再关闭活塞K
D. 启普发生器也可用于碳酸钠晶体与稀硫酸反应制备二氧化碳
难度: 中等查看答案及解析
-
某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)
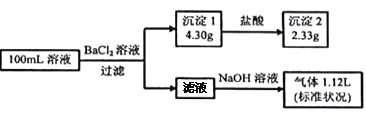
下列说法不正确的是
A. 原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B. 若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
C. 原溶液中c(Cl-)≥0.1mol·L-1
D. 原溶液一定存在Cl-,可能存在Na+
难度: 困难查看答案及解析