-
氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:

已知:① Cr2O72-+H2O 2CrO42-+2H+;
2CrO42-+2H+;
② CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式____________________________________,所加40%NaOH不宜过量太多的原因是______________________________。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_________________,反应后从剩余溶液中分离出CH3OH的实验方法是_____________。
(3)使用下列用品来测定溶液的pH,合理的是_________(填字母)。
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体 _______________________,蒸发浓缩,__________,过滤, ______________,低温干燥,得到CrCl3·6H2O(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体42.64g,则该实验的产率为_________。
-
氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:
已知:① Cr2O72-+H2O 2CrO42-+2H+;
2CrO42-+2H+;
② CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式____________________________________,所加40%NaOH不宜过量太多的原因是______________________________。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_________________,反应后从剩余溶液中分离出CH3OH的实验方法是_____________。
(3)使用下列用品来测定溶液的pH,合理的是_________(填字母)。
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体 _______________________,蒸发浓缩,__________,过滤, ______________,低温干燥,得到CrCl3·6H2O(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体42.64g,则该实验的产率为_________。
-
氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:

已知:①Cr2O72-+H2O 2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)碱溶的目的是__________,所加40%NaOH不宜过量太多的原因是______________________。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_____________。
(3)使用下列用品来测定溶液的pH,合理的是_____(填字母)。
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。

①图中仪器A的名称为_______。
②在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:___________。
(5)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体_____,____,冷却结晶,过滤,____,低温干燥,得到CrCl3·6H2O。(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)
-
CrCl3·6H2O是中学化学中的常见物质,工业上用铬酸钠(Na2CrO4)来制备。某兴趣小组以实验室中的红矾钠(Na2Cr2O7)为原料来制备CrCl3·6H2O。流程如下:

已知:
a.CrCl3·6H2O不溶于乙醚,易溶于水、乙醇、易水解。
b.CrCl3·6H2O易升华,在高温下能被氧化。
(1)步骤Ⅰ中加入40%NaOH的目的是__________________________。步骤1中甲醇作为还原剂,反应后生成CO2,请写出反应的离子方程式_________________________。
(2)步骤Ⅲ,请补充完整由步骤Ⅱ得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:
ⅰ:将过滤后所得固体溶解于过量的盐酸中,ⅱ: ,ⅲ:过滤,ⅳ:洗涤,ⅴ:干燥,得到CrCl3·6H2O。
①操作ⅱ为_________________________________。
②操作ⅳ最合适的洗涤剂是_____________。
A.乙醇 B.乙醚 C.冷水
③操作ⅴ应选择的干燥方式为_____________。
(3)样品中三氯化铬质量分数的测定
称取样品,加水溶解并定容于容量瓶中。移取一定体积溶液于碘量瓶(一种带塞的锥形瓶)中,加入Na2O2,在一定条件下充分反应后,适当稀释,然后加入过量的稀H2SO4至溶液呈强酸性,此时铬以 存在。充分加热煮沸后,加入KI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用硫代硫酸钠溶液滴定至终点。
存在。充分加热煮沸后,加入KI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用硫代硫酸钠溶液滴定至终点。
①充分加热煮沸的原因是 _______________________。
②在使用硫代硫酸钠溶液滴定过程中使用到碱式滴定管,选出其正确操作并按顺序列出字母:蒸馏水洗涤→加入待量液3~5mL→_____→_____→_____→_____→_____→滴定,进行实验。
a.加液至“0”刻度以上2~3cm
b.倾斜转动滴定管,使液体润湿滴定管内壁,挤压玻璃球,放液
c.调整至“0”或“0”刻度以下,静止1min,读数
d.将滴定管尖端插入锥形瓶内约1cm
e.将滴定管尖端对准锥形瓶,且置于锥形瓶口上方约1cm处
f.右手拿住滴定管使它倾斜30°,左手迅速打开活塞
g.橡皮管向上弯曲,挤压玻璃球,放液
③下图是碱式滴定管的内部构造,滴定时,左手应该捏住乳胶管中玻璃球的______部位(填“a”、“b”或“c”),挤捏乳胶管,使其与玻璃球之间形成一条缝隙,溶液即可流出。
-
氯化铬晶体 是一种重要的工业原料,工业上常用铬酸钠
是一种重要的工业原料,工业上常用铬酸钠 来制备。实验室中以红矾钠
来制备。实验室中以红矾钠 为原料制备
为原料制备 的流程如下:
的流程如下:

已知:① ;
;
② 不溶于乙醚,易溶于水、乙醇,易水解;
不溶于乙醚,易溶于水、乙醇,易水解;
③甲醇,无色液体,有毒,沸点64.7,易燃。
请回答:
(1)碱溶的目的是________________。
(2)还原时先加入过量 再加入10%HCl,生成
再加入10%HCl,生成 ,该反应的离子方程式为________________。
,该反应的离子方程式为________________。
(3)用蒸馏法从滤液中分离出 循环使用。
循环使用。
①下列有关蒸馏实验说法正确的是_________(填序号)。
A.蒸馏开始,应先加热再通冷凝水
B.通过蒸馏可除去液体中难挥发或不挥发的杂质
C.若温度计插入混合液中,则会收集到沸点偏高的杂质
D.当蒸馏沸点过高的成分时,应用空气冷凝
②实验设计用下图装置进行蒸馏,该装置中存在的错误有_________。
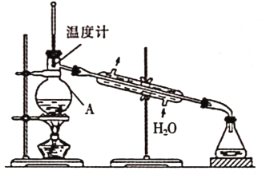
③在改正后的装置中,在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的 。有的同学认为,该过程中需要加入CaO,防止水随
。有的同学认为,该过程中需要加入CaO,防止水随 一起蒸出,你认为是否有必要并说明理由:_______。
一起蒸出,你认为是否有必要并说明理由:_______。
(4)请补充完整由过滤后得到的固体 制备
制备 的实验方案(可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚):将过滤后所得固体__________,__________,冷却结晶,过滤,__________,低温干燥,得到
的实验方案(可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚):将过滤后所得固体__________,__________,冷却结晶,过滤,__________,低温干燥,得到 。
。
-
硫酸亚铁晶体俗称绿矾(FeSO4 • 7H2O),重铬酸钠晶体俗称红矾钠(Na2Cr2O7·2H2O),它们都是重要的化工产品。工业上以铬铁矿[主要成分是[Fe(CrO2)2]为原料制备绿矾和红矾钠的工艺流程如图所示。
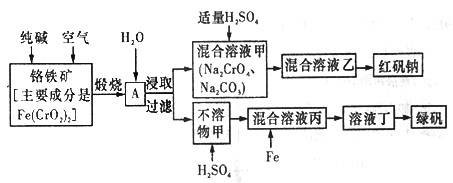
请回答下列问题:
(1)已知Fe(CrO2)2中铬元素的化合价为+3价,则Fe(CrO2)中铁元素的化合价为______________。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3写成Na2O·SiO2,则Fe(CrO2)2可写成__________。
(3)煅烧铬铁矿时,矿石中的Fe(CrO2)2转变成可溶于水的Na2CrO4,反应的化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2 2Fe2O3+8Na2CrO4+8CO2
2Fe2O3+8Na2CrO4+8CO2
①该反应中还原剂与氧化剂的物质的量之比为________________。
②为了加快该反应的反应速率,可采取的措施是_________________(填一种即可)。
⑷己知CrO42-在氢离子浓度不同的酸性溶液中有不同的反应。如:
2CrO42-+2H+=Cr2O72-+H2O 3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是________________。
②混合溶液乙中溶质的化学式为______________________。
(5)写出Fe与混合溶液丙反应的主要离子方程式_________________。检验溶液丁中无Fe3+的方法是:_____________。从溶液丁到绿巩的实验操作为蒸发浓缩、___________、过滤、洗涤、干燥。
-
重铬酸钠晶体俗称红矾钠,是重要的化工产品和强氧化剂。工业上用含有Al2O3、Fe2O3等杂质的铬铁矿【主要成份为Fe(CrO2)2】为主要原料生产重铭酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:
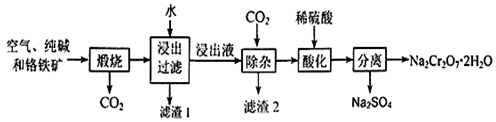
已知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,放出CO2气体,同时发生反应:A12O3+Na2CO3 2NaAlO2+CO2↑。请回答下列问题:
2NaAlO2+CO2↑。请回答下列问题:
(1)煅烧前通常将铬铁矿粉碎,原因是 。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(3)滤渣2的成分为 (填写化学式)
(4)请写出用稀硫酸酸化处理时发生反应的离子方程式 、 。
(5)称取重铬酸钠晶体试样2.500g配成250ml溶液,取出25ml于锥形瓶中,加入10mL 2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断滴定达到终点的现象是 ;
②若实验中共用去Na2S2O3标准溶液40.00ml,则所得产品Na2Cr2O7·2H2O的纯度为 (设整个过程中其它杂质不参加反应)
-
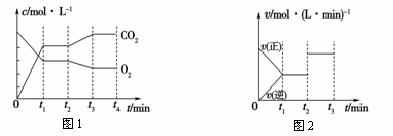
红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+Cr2O3(s)+8Na2CO3(s)+7O2(g) 8Na2CrO4(s)+
8Na2CrO4(s)+
2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K= 。
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是____________________(用文字表达);
由图2判断,t2到t3的曲线变化的原因可能是________(填写序号)。
A.升高温度 B.加了催化剂 C.通入O2 D.缩小容器体积
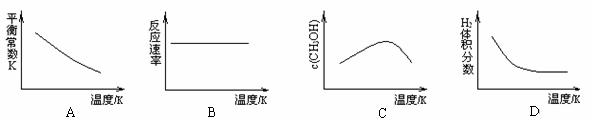
(3) 工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图像正确的是 。
CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图像正确的是 。
-
工业上以铬铁矿(主要成分Fe0.Cr2O3,还含少量Al2 O3)生产重要的化工原料红矾钠(即重铬酸钠晶体,化学式为Na2Cr2O7·2H2O)及铬酐(CrO3)的工艺流程如下:
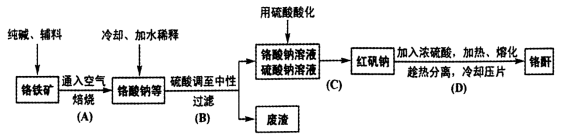
回答下列问题:
(1)步骤A中主反应生成Na2CrO4的化学方程式为 , 副反应主要有:Fe2O3 +Na2CO3 2NaFeO2 +CO2 和
2NaFeO2 +CO2 和
(2)步骤A中往高温焙烧炉中加入的辅料是石灰石,其主要目的不是造渣,但不加石灰石,主反应速率将很慢,而且反应不完全。由此可知,加石灰石的主要作用是
(3)步骤B中形成废渣的主要成分是 。
(4)右图是红矾钠和硫酸钠的溶解度曲线。据此,步骤C操作的方法是:将硫酸酸化铬酸钠和硫酸钠所得的混合溶液 (填操作名称),趁热过滤得到的晶体是 (填化学式);然后将所得滤液 (填操作名称),过滤得到的晶体是 。
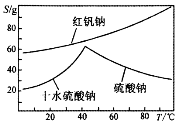
(5)C步中用硫酸酸化,能否用盐酸酸化: ,理由是 ;酸化时为什么酸度不能太低:___________。
-
锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验窒重要的分析试剂,工业上常用天青石(主要成分为SrSO4)为原料制备,生成流程如下:
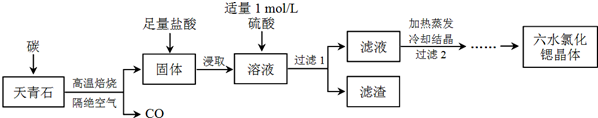
已知:①经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
②SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③SrCl2•6H2O的摩尔质量为:267g/mol.
(1)天青石焙烧前先研磨粉碎,其目的是_________________
(2)隔绝空气高温焙烧,若0.5mol SrSO4中只有S被还原,转移了4mol电子.写出该反应的化学方程式_________________
(3)为了得到较纯的六水氯化锶晶体,过滤2后还需进行的两步操作是_________________
(4)加入硫酸的目的是_________________;为了提高原料的利用率,滤液中Sr2+的浓度应不高于__________ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(5)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2mol的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。①滴定反应达到终点的现象是_________________;
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl2•6H2O的质量百分含量为_______(保留4位有效数字)。

2CrO42-+2H+;













