-
重铬酸钠晶体俗称红矾钠,是重要的化工产品和强氧化剂。工业上用含有Al2O3、Fe2O3等杂质的铬铁矿【主要成份为Fe(CrO2)2】为主要原料生产重铭酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:
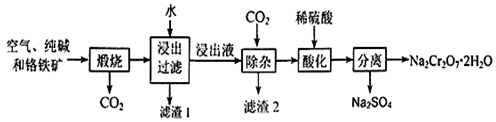
已知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,放出CO2气体,同时发生反应:A12O3+Na2CO3 2NaAlO2+CO2↑。请回答下列问题:
2NaAlO2+CO2↑。请回答下列问题:
(1)煅烧前通常将铬铁矿粉碎,原因是 。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(3)滤渣2的成分为 (填写化学式)
(4)请写出用稀硫酸酸化处理时发生反应的离子方程式 、 。
(5)称取重铬酸钠晶体试样2.500g配成250ml溶液,取出25ml于锥形瓶中,加入10mL 2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断滴定达到终点的现象是 ;
②若实验中共用去Na2S2O3标准溶液40.00ml,则所得产品Na2Cr2O7·2H2O的纯度为 (设整个过程中其它杂质不参加反应)
-
重铬酸钠晶体  俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿 主要成份为
主要成份为 ,还含有
,还含有 、MgO、
、MgO、 等杂质
等杂质 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:

①中涉及的主要反应有:
主反应:

副反应: 、
、
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
试回答下列问题:
 “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
 “③”中调节pH至
“③”中调节pH至 ,目的是 ______ .
,目的是 ______ .
 “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使 转化为
转化为 ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
 称取重铬酸钠试样
称取重铬酸钠试样 配成250mL溶液,取出
配成250mL溶液,取出 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL  和足量碘化钠
和足量碘化钠 铬的还原产物为
铬的还原产物为 ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用 标准溶液滴定
标准溶液滴定
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去 标准溶液
标准溶液 ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应 ______ .
______ .
-
重铬酸钠晶体  俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿 主要成份为
主要成份为 ,还含有
,还含有 、MgO、
、MgO、 等杂质
等杂质 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
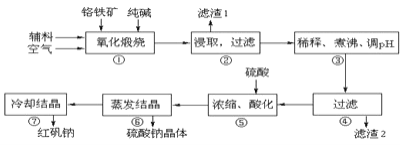
①中涉及的主要反应有:
主反应:

副反应: 、
、
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
试回答下列问题:
 “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
 “③”中调节pH至
“③”中调节pH至 ,目的是 ______ .
,目的是 ______ .
 “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使 转化为
转化为 ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
 称取重铬酸钠试样
称取重铬酸钠试样 配成250mL溶液,取出
配成250mL溶液,取出 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL  和足量碘化钠
和足量碘化钠 铬的还原产物为
铬的还原产物为 ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用 标准溶液滴定
标准溶液滴定
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去 标准溶液
标准溶液 ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应 ______ .
______ .
-
重铬酸钠(Na2Cr2O7?2H2O)俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿(主要成份为FeO?Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,c其主要工艺流程如下:

①中涉及的主要反应有:
主反应:4FeO?Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应: SiO2+Na2CO3 Na2SiO3+CO2↑ Al2O3+Na2CO3
Na2SiO3+CO2↑ Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1) “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是________;
(2) “③”中调节pH至4.7,目的是________;
(3) “⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:________;
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol?L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol?L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是: ________
②若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度________
(设整个过程中其它杂质不参与反应)
-
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
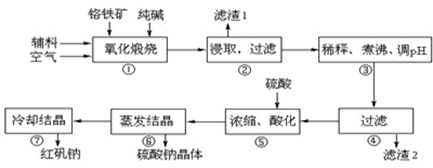
中涉及的主要反应有:
主反应:4FeO•Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应: SiO2+Na2CO3 Na2SiO3+CO2↑ Al2O3+Na2CO3
Na2SiO3+CO2↑ Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是________;
(2)“③”中调节pH至4.7,目的是________;
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:________;
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol•L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol•L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是: ________。
②若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度________(设整个过程中其它杂质不参与反应) 。
-
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
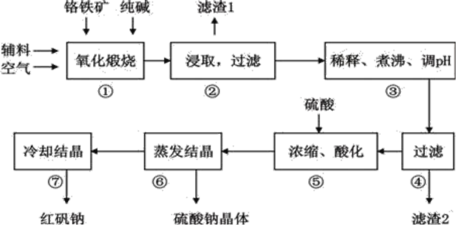
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是__________________;
(2)③中调节pH至4.7,目的是__________________;
(3)⑤中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:__________________;
(4)⑦中采用冷却结晶的方法析出红矾钠,依据是_________________________ ;
(5)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__________________mol·L-1,后续废水处理方能达到排放标准。
②还原法:CrO42- Cr3+
Cr3+ Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。
Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。
-
(16分)重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
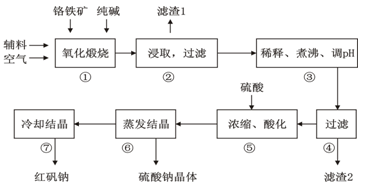
①中涉及的主要反应有:
主反应: 4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3  Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3  2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)“③”中调节pH至4.7,目的是 。
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。
(4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法:
CrO42- Cr3+
Cr3+ Cr(OH)3。绿矾还原CrO42-的离子方程式为:
Cr(OH)3。绿矾还原CrO42-的离子方程式为:
。
用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是 Kg(保留两位小数)。
步骤⑦的操作是 。为进一步得到较为纯净的红矾钠的操作是
-
硫酸亚铁晶体俗称绿矾(FeSO4 • 7H2O),重铬酸钠晶体俗称红矾钠(Na2Cr2O7·2H2O),它们都是重要的化工产品。工业上以铬铁矿[主要成分是[Fe(CrO2)2]为原料制备绿矾和红矾钠的工艺流程如图所示。
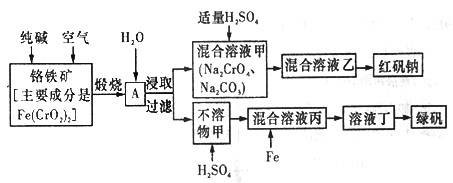
请回答下列问题:
(1)已知Fe(CrO2)2中铬元素的化合价为+3价,则Fe(CrO2)中铁元素的化合价为______________。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3写成Na2O·SiO2,则Fe(CrO2)2可写成__________。
(3)煅烧铬铁矿时,矿石中的Fe(CrO2)2转变成可溶于水的Na2CrO4,反应的化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2 2Fe2O3+8Na2CrO4+8CO2
2Fe2O3+8Na2CrO4+8CO2
①该反应中还原剂与氧化剂的物质的量之比为________________。
②为了加快该反应的反应速率,可采取的措施是_________________(填一种即可)。
⑷己知CrO42-在氢离子浓度不同的酸性溶液中有不同的反应。如:
2CrO42-+2H+=Cr2O72-+H2O 3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是________________。
②混合溶液乙中溶质的化学式为______________________。
(5)写出Fe与混合溶液丙反应的主要离子方程式_________________。检验溶液丁中无Fe3+的方法是:_____________。从溶液丁到绿巩的实验操作为蒸发浓缩、___________、过滤、洗涤、干燥。
-
化工原料红矾钠(重铬酸钠:Na2Cr27-2H20)主要是以铬铁矿(主要成份为FeO-Cr2O3,还含有A123,Si02等杂质)为主要原料生产,其主要工艺流程如图1:

步骤①中主要反应的化学方程式为:Fe0•Cr2O3+8Na2C03+702=8Na2Cr04+2Fe2O3+8C02
(I)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是________..
(2)杂质A123,SiO2在①中转化的化学反应方程式为________
(3)用化学平衡移动原理说明③中煮沸的作用是________(用离子方程式结合文字说明),若调节pH过低产生的影响是________
(4)⑤中酸化是使Cr042一转化为Cr272一,写出该反应的离子方程式:________
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如图2:
阴极发生的电极反应式为:________
阳极发生的电极反应式为:________.
-
二水合重重铬酸钠(Na2Cr2O7.2H2O),[已知M(Na2Cr2O7.2H2O)=298g/mol]俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO.Cr2O3,还含有A1203、MgO、Si02等杂质)为主要原料生产,其主要工艺流程如图:

已知信息:
Ⅰ.“①”中涉及的主要反应是:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
Ⅱ.部分阳离子以氢氧化物形式完全沉淀时溶液的PH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液PH | 4.7 | 3.7 | 11.2 | 5.6 |
(1).杂质A12O3、SiO2与纯碱反应转变为可溶性盐,写出A12O3纯碱反应的化学方程式为:______________,滤渣1的主要成分为__________________。
(2).“③”中通过调节PH除去杂质,调节PH至___________。
(3).“⑤”中向滤液中加入物质A,得到Na2Cr2O3和Na2SO4的混合溶液,物质A为__________,简述原因:______________________________。(用离子方程式及文字加以说明)
(4).如图是Na2Cr2O3.2H2O和Na2SO4的溶解度曲线。提纯的实验操作:将Na2Cr2O3和Na2SO4的混合溶液______________________,得到Na2SO4固体和较纯净的Na2Cr2O3溶液。

(5).实验室测定所得产品中红矾钠的纯度,称取产品3.2g,配成250mol溶液,取出25.00mL于锥形瓶中,加入10mL2mol/LH2SO4和足量碘化钾,放于暗处5min,写出离子方程式:________________。然后加水100mL,加入3mL淀粉指示剂,用0.1000mol/LNa2S2O3标准溶液滴定I2+2S2O32-=2I-+S4O62-若达到滴定终点时,共用去Na2S2O3标准溶液60mL,所得产品的纯度是_________(结果保留小数点后1位)。

2NaAlO2+CO2↑。请回答下列问题:









