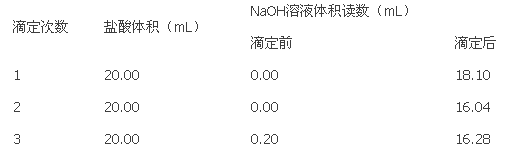
-
下列物质的分类组合全部正确的是
编组
强电解质
弱电解质
非电解质
A
NaCl
H2O
Cl2
B
H2SO4
CaCO3
CCl4
C
HCl
HClO
氨水
D
Ba(OH)2
CH3COOH
C2H5OH
难度: 中等查看答案及解析
-
下列实验装置或操作设计正确且能达到实验目的的是
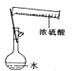
A. 配制一定物质的量浓度的稀硫酸
 B. 制取少量的氢氧化铁胶体
B. 制取少量的氢氧化铁胶体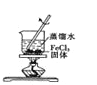 C. 用硫酸标准溶液滴定氢氧化钠溶液
C. 用硫酸标准溶液滴定氢氧化钠溶液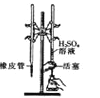 D. 称量氢氧化钠固体
D. 称量氢氧化钠固体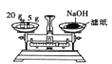
难度: 中等查看答案及解析
-
下列水溶液一定呈中性的是
A. c(NH4+)=c(C1-)的NH4Cl 溶液
B. c(H+)=1×10-7mol·L-1的溶液
C. pH=7的溶液
D. 室温下将pH=3的酸与pH= 11的碱等体积混合后的溶液
难度: 中等查看答案及解析
-
关于pH的测定下列说法正确的是
A. pH试纸在使用之前应用蒸馏水润湿
B. 用广泛pH试纸测得某盐酸的pH=2.3
C. 利用酸碱指示剂可以测溶液的pH
D. pH计是精确测定溶液pH的仪器
难度: 简单查看答案及解析
-
下列物质在常温下发生水解时,对应的离子方程式正确的是
A. FeCl3:Fe3++3H2O
Fe(OH)3 + 3H+
B. NH4Cl:NH4++H2O
NH3↑ + H2O + H+
C. CH3COONa:CH3COO-+H2O ==CH3COOH + OH-
D. Na2CO3:CO32-+2H2O
H2CO3+ 2OH-
难度: 中等查看答案及解析
-
能说明醋酸是弱电解质的事实是
A. 醋酸溶液的导电性比盐酸弱
B. 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳
C. 醋酸溶液用水稀释后,氢离子浓度下降
D. 0.1mol·L-1的CH3COOH溶液中,氢离子的浓度约为0.001mol·L-1
难度: 简单查看答案及解析
-
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
A. 减小、增大、减小 B. 增大、减小、减小
C. 减小、增大、增大 D. 增大、减小、增大
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O⇌H++OH-,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数不变
C. 向水中加人少量固体NaOH,平衡正向移动,c(H+)降低
D. 将水加热,水的离子积常数增大,pH不变
难度: 中等查看答案及解析
-
某浓度的氨水中存在下列平衡:NH3•H2O⇌NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是
A. 适当升高温度 B. 通入NH3
C. 加入NH4Cl固体 D. 加入少量氢氧化钠
难度: 中等查看答案及解析
-
某温度下,在恒容密闭容器中进行反应:X(g)+Y(g
Z(g) + W(s) △H>0。下列叙述正确的是
A. 加入少量W,逆反应速率增大
B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡向逆反应方向移动
D. 平衡后,加入X,该反应的△H增大
难度: 中等查看答案及解析
-
某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4,在调节溶液pH值时应选用的试剂是
A. NaOH B. NH3·H2O C. ZnO D. Fe2O3
难度: 中等查看答案及解析
-
在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O⇌HCO3-+OH-。下列说法正确的是
A. 稀释溶液,水解平衡向逆反应方向移动,水解程度减小
B. 通入CO2,平衡向正反应方向移动
C. 升高温度,pH减小
D. 加入NaOH固体,溶液的pH减小
难度: 中等查看答案及解析
-
下列说法正确的是
A. 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
C. 表示硫的燃烧热的热化学方程式是S(g)+1.5O2(g)=SO3(g) △H=-315KJ/mol
D. 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1,则知:石墨比金刚石稳定
难度: 中等查看答案及解析
-
在一定温度下某恒容容器中,当下列物理量不再发生变化时,能表明反应A(g)+2B(g)
C(g)+D(g)已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤
C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
难度: 简单查看答案及解析
-
在水溶液中,因为发生水解反应而不能大量共存的一组微粒是
A. CO32-、OH-、Na+、H+ B. Al3+、Na+、Cl-、HCO3-
C. Ba2+、HCO3—、K+、SO42- D. S2-、H+、SO42-、Cu2+
难度: 中等查看答案及解析
-
下列有关问题,与盐的水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②明矾可作净水剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液并灼烧得到Al2O3固体
A. ①②③ B. ②③④ C. ①④⑤ D. ①②③④⑤
难度: 中等查看答案及解析
-
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的
A. 该反应的化学平衡常数表达式是
B. 此时B的平衡转化率是40%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增加B,平衡向右移动,B的平衡转化率增大
难度: 简单查看答案及解析
-
在N2(g)+3H2(g)
2NH3(g)的平衡体系中,其他条件不变,增大c(N2),则正确的是
A. 氮气的转化率增大 B. 氢气的转化率不变
C. 氨气在平衡混合气体中的含量一定增大 D. 氨气在平衡混合气体中的物质的量增多
难度: 简单查看答案及解析
-
某温度下,H2(g)+CO2(g)
H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是

A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D. 平衡时,乙中CO2的转化率大于60%
难度: 简单查看答案及解析
-
在0.1mol•L-1CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡,下列叙述正确的是
A. 加入水时,平衡向逆反应方向移动
B. 加入少量CH3COONa固体,平衡向逆反应方向移动,c(CH3COO-)增大
C. 加入少量0.1 mol•L-1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小
D. 加入少量NaOH固体,平衡向正反应方向移动,酸性增强
难度: 中等查看答案及解析
-
在密闭容器中,可逆反应3X(g)+Y(s)
2Z(g);△H<0,达到平衡后,仅改变横坐标条件,下列图像正确的是
A.
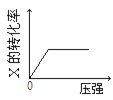 B.
B. C.
D.
难度: 中等查看答案及解析
-
可逆反应A(?)+aB(g)
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是
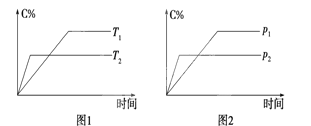
A. 若a=2,则A为液态或固体
B. 该反应的正反应为放热反应
C. T2>T1,P2>P1
D. 其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大
难度: 困难查看答案及解析
-
关于pH都等于9的两种溶液:①NaOH溶液 ②CH3COONa溶液,下列说法正确的是
A. 加水稀释相同倍数后溶液的pH:①=②
B. 由水电离产生的OH-物质的量浓度:①>②
C. 升高相同温度后,溶液pH:①=②
D. 两种溶液中的Na+物质的量浓度:①<②
难度: 中等查看答案及解析
-
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是
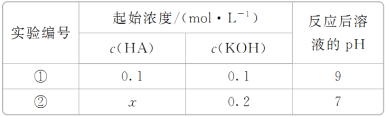
A. 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B. 0.1 mol·L-1HA的溶液中由水电离出的c(H+)=1×10-13 mol·L-1
C. 实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol·L-1
D. 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
难度: 困难查看答案及解析
-
如图是常温下向20.0 mL的盐酸中,逐滴加入0.10 mol·L-1 NaOH溶液时,溶液的pH随 NaOH溶液的体积V(mL)变化的曲线,根据图像所得的下列结论中正确的是
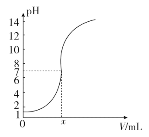
A. 原盐酸的浓度为0.10 mol·L-1
B. x的值为2.0
C. 当pH=12时,V值为20.4
D. 原盐酸的浓度为1.0 mol·L-1
难度: 困难查看答案及解析
-
对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加适量的醋酸钠晶体后,两溶液的c(H+)均减小
B. 使温度都升高20℃后,两溶液的c(H+)均不变
C. 加水稀释2倍后,两溶液的c(H+)均增大
D. 加足量的锌充分反应后,两溶液中产生的氢气一样多
难度: 中等查看答案及解析
-
298 K时,在20.0 mL 0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1 氨水的电离度为1.32%,下列有关叙述正确的是
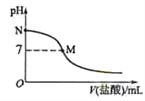
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0 mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
难度: 中等查看答案及解析
-
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
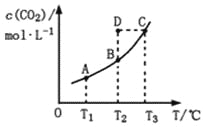
A. 反应CO(g)+H2O(g)
CO2(g)+H2(g)的ΔH>0
B. 在T2时,若反应处于状态D,则一定有ν正<ν逆
C. 平衡状态A与C相比,平衡状态A的c(CO)小
D. 若T1、T2时的平衡常数分别为K1、K2,则K1<K2
难度: 困难查看答案及解析
-
已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是
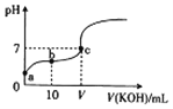
A. a点溶液中c(H+)为4.0×10-5mol/L
B. c点溶液中的离子浓度大小顺序为c(K+)>c(CH3COO-)>c(H+)=c(OH-)
C. V=20
D. a、b、c三点中水的电离程度最大的是c点
难度: 困难查看答案及解析
-
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中Ba2+恰好完全沉淀时,溶液pH=11,若反应后溶液体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1︰9 B. 1︰1 C. 1︰2 D. 1︰4
难度: 中等查看答案及解析