-
下列说法正确的是( )
A. 含有共价键的化合物一定是共价化合物
B. 由共价键形成的分子一定是共价化合物
C. 分子中只有共价键的化合物一定是共价化合物
D. 只有非金属原子间才能形成共价键
难度: 中等查看答案及解析
-
当H原子和F原子沿z轴结合成HF分子时,F原子中和H原子对称性不一致的轨道是( )
A. 1s B. 2s C. 2px D. 2pz
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 若把H2S分子写成H3S分子,违背了共价键的饱和性
B. H3O+离子的存在,说明共价键不应有饱和性
C. 所有共价键都有方向性
D. 两个原子轨道发生重叠后,两核间的电子不仅仅存在于两核之间,而是绕两个原子核运动
难度: 简单查看答案及解析
-
下列各组指定的元素不能形成AB2型化合物的是( )
A. 1s22s22p2和1s22s22p4 B. 1s22s22p63s23p4和1s22s22p4
C. 1s22s22p63s2和1s22s22p5 D. 1s22s22p5和1s22s22p4
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.3p2表示3p能级有2个轨道
B.1s22s12p1表示的是激发态原子的电子排布
C.M能层中的原子轨道数目为3
D.处于同一轨道上的电子可以有多个,它们的自旋状态相同
难度: 简单查看答案及解析
-
下列共价键的键能最大的是( )
A. H—F B. H—O C. H—N D. H—C
难度: 中等查看答案及解析
-
下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A. 基态原子的N层上只有一个电子的元素,一定是ⅠA族元素
B. 基态原子的价电子排布为(n-1)d6~8ns2的元素一定是副族元素
C. 基态原子的p能级上半充满的元素一定位于p区
D. 基态原子的价电子排布为(n-1)dxnsy的元素的族序数一定为x+y
难度: 中等查看答案及解析
-
下列含氧酸酸性最强的是( )
A. HClO B. H2CO3 C. H2SO4 D. H2SO3
难度: 中等查看答案及解析
-
关于金属性质和原因的描述正确的是( )
A. 金属一般具有银白色光泽是物理性质,与金属键没有关系
B. 金属具有良好的导电性,是因为在金属晶体中共享了金属原子的价电子,形成了“电子气”,在外电场的作用下自由电子定向移动便形成了电流,所以金属易导电
C. 金属具有良好的导热性能,是因为自由电子在受热后,加快了运动速率,电子与电子间传递了能量,与金属阳离子无关。
D. 金属晶体具有良好的延展性,是因为金属晶体中的原子层可以滑动而破坏了金属键
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. NH3、CO、CO2都是极性分子
B. CH4、CCl4都是含有极性键的非极性分子
C. HF、HCl、HBr、HI的稳定性依次增强
D. CS2、H2O、C2H2都是直线型分子
难度: 中等查看答案及解析
-
下列关于元素第一电离能的说法不正确的是( )
A. 钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B. 因同周期元素的原子半径从左到右逐渐减小,故第一电离能必定依次增大
C. 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大
D. 对于同一元素而言,原子的逐级电离能越来越大
难度: 中等查看答案及解析
-
下列配合物的配位数不是6的是
A. K3[Fe(SCN)6] B. Na2[SiF6]
C. Na3[AlF6] D. [Cu(NH3)4]Cl2
难度: 中等查看答案及解析
-
对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了8个电子的结构。则一个三硫化四磷分子中含有的共价键个数是
A. 7个 B. 9个 C. 19个 D. 不能确定
难度: 中等查看答案及解析
-
下列说法正确的是
A. 基态氧原子中未成对电子数是0
B. 基态氮原子中未成对电子数是3
C. 基态碳原子中未成对电子数是4
D. 基态铜原子中未成对电子排布在3d轨道
难度: 简单查看答案及解析
-
金属晶体的形成是因为晶体中存在
①金属原子 ②金属阳离子 ③自由电子 ④阴离子
A. 只有① B. 只有③ C. ②③ D. ②④
难度: 简单查看答案及解析
-
金属晶体和离子晶体是重要晶体类型。下列关于它们的说法中,正确的是
A. 金属晶体和离子晶体都能导电
B. 在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用
C. 金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式
D. 金属晶体和离子晶体中分别存在金属键和离子键等相互作用,很难断裂,因而都具有延展性
难度: 简单查看答案及解析
-
一种价电子排布为2s22p5的元素,下列有关它的描述正确的有
A. 原子序数为8
B. 在同周期元素中非金属性最强
C. 在同周期元素中,其原子半径最大
D. 在同周期元素中,元素的第一电离能最大
难度: 简单查看答案及解析
-
某物质熔融状态可导电,固态可导电,将其投入水中,水溶液也可导电,则可推测该物质可能是
A. 金属 B. 非金属 C. 可溶性碱 D. 可溶性盐
难度: 中等查看答案及解析
-
下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是
A. sp杂化轨道的夹角最大 B. sp2杂化轨道的夹角最大
C. sp3杂化轨道的夹角最大 D. sp3、sp2、sp杂化轨道的夹角相等
难度: 中等查看答案及解析
-
某元素X的逐级电离能如图所示,下列说法正确的是( )
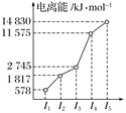
A. X元素可能为+4价 B. X可能为非金属
C. X为第五周期元素 D. X与氯反应时最可能生成的阳离子为X3+
难度: 中等查看答案及解析
-
下列化合物中阴离子半径和阳离子半径之比最大的是
A. LiI B. NaBr C. KCl D. CsF
难度: 中等查看答案及解析
-
我国科学家研制出一中催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:
HCHO+O2
CO2+H2O。下列有关说法正确的是
A. 该反应为吸热反应 B. CO2分子中的化学键为非极性键
C. HCHO分子中既含σ键又含π键 D. 每生成1.8gH2O消耗2.24L O2
难度: 中等查看答案及解析
-
金属元素铊的相关信息如下图所示。下列有关卡片信息解读错误的是( )

A. Tl是铊的元素符号 B. 铊元素的中子数81
C. 铊位于第六周期ⅢA族 D. 铊属于金属元素
难度: 简单查看答案及解析
-
下列大小关系正确的是( )
A. 晶格能:NaCl<NaBr B. 硬度:MgO>CaO C. 熔点:NaI>NaBr D. 熔沸点:CO2>NaCl
难度: 中等查看答案及解析
-
在物质结构研究的历史上,首先提出原子内有原子核的科学家是
A.
 B.
B. 
C.
 D.
D. 
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.若把H2S分子写成H3S分子,违背了共价键的饱和性
B.H3O+离子的存在,说明共价键不应有饱和性
C.所有共价键都有方向性
D.两个原子之间形成共价键时,可形成多个σ键
难度: 简单查看答案及解析
-
某有机物
 ,经过下列反应后,该物质一定不含手性碳的是
,经过下列反应后,该物质一定不含手性碳的是A. 酯化反应 B. 水解反应
C. 催化氧化 D. 消去反应
难度: 中等查看答案及解析
-
下列电子排布图所表示的元素原子中,其能量处于最低状态的是 ( )
A.
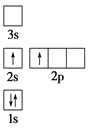 B.
B. 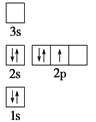 C.
C. 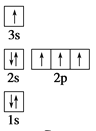 D.
D. 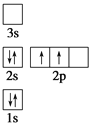
难度: 中等查看答案及解析
-
支持固态氨是分子晶体的事实为( )
A. 氮原子不能形成阳离子 B. 铵离子不能单独存在
C. 常温下氨是气态物质 D. 氨极易溶于水
难度: 中等查看答案及解析
-
最近科学家发现了一种新分子,它具有空心的类似足球的结构,分子式为C60,下列说法正确的是
A. C60是一种新型的化合物
B. C60和石墨都是碳的同素异形体
C. C60中虽然没有化学键,但固体为分子晶体
D. C60相对分子质量为720g/mol
难度: 简单查看答案及解析