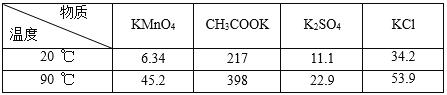
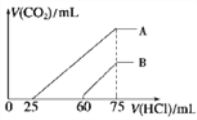
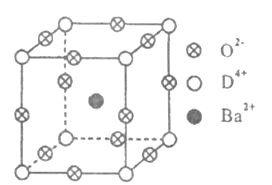
-
用NA表示阿伏伽德罗常数,下列说法正确的是
A. 10g 46%的乙醇水溶液中,氧原子的个数为0.4NA
B. 标准状况下,22.4LCCl4含有的分子数为NA
C. 在含4mol Si-O键的二氧化硅晶体中,氧原子的数目为4NA
D. 向含有0.1mol的FeI2溶液中通入足量Cl2,充分反应后转移的电子数为0.2NA
难度: 中等查看答案及解析
-
化学与人类生活、能源开发、资源利用等密切相关。下列说法正确的是
A. 塑料奶瓶比玻璃奶瓶更有利于健康,且更加经久耐用
B. 硅燃烧放出的热量多,且燃烧产物对环境污染程度低,可做“未来石油”
C. 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,但不能沉降水中的悬浮物
D. 研发使用高效催化剂,可提高反应中原料的转化率
难度: 困难查看答案及解析
-
下列各组离子能大量共存,当溶液中c(H+)=10-1 mol/L时,只能观察到有气体产生;而当溶液中c(H+)=10-13mol/L时,只能观察到生成沉淀。该组离子可能是
A. Mg2+、NH4+、SO42-、Cl-、S2O32-
B. Pb2+、Ba2+、K+、Cl-、S2-
C. Pb2+、Fe2+、Na+、SO42-、NO3-
D. Na+、Mg2+、NO3-、HCO3-、SO42
难度: 中等查看答案及解析
-
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150ml 4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A. 0.21 mol
B. 0.25 mol
C. 0.3 mol
D. 0.35 mol
难度: 中等查看答案及解析
-
体积为V mL,密度为ρ g/mL的含有相对分子质量为M的某种物质的溶液,其中溶质为mg,其物质的量浓度为c mol/L,溶质的质量分数为w%,则下面表示正确的是
A.
B.
C.
D.
难度: 困难查看答案及解析
-
下列表示对应化学反应的离子方程式,其中正确的是
A. 向NaA1O2溶液中通入足量的CO2:A1O2-+CO2+2H2O=A1(OH)3↓+HCO3-
B. (NH4)2Fe(SO4)2溶液中加入过量的氢氧化钡溶液:2NH4++Fe2++4OH-=Fe(OH)2↓+2NH3·H2O
C. NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. 向H218O中投入Na2O2固体:2H218O+2Na2O2=2Na++4OH-+18O2↑
难度: 中等查看答案及解析
-
mg铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加amol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值ng,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-离子的物质的量为aVmol
③反应过程中转移的电子的物质的量为
mol
④生成NO气体的体积室温下为
L
⑤与合金反应的硝酸的物质的量为(
)mol
A. 2项 B. 3项 C. 4项 D. 5项
难度: 中等查看答案及解析
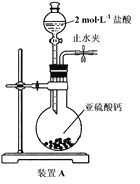
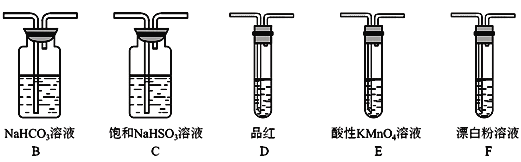
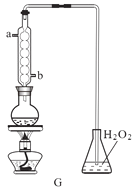
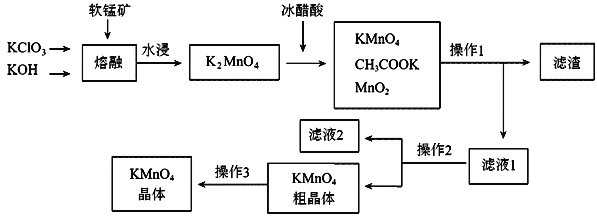
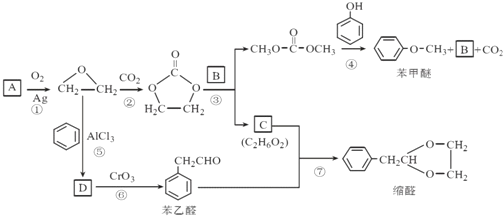
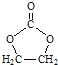 的合成路线,设计一条由2−氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2−氯丙烷和必要的无机试剂制备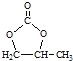 的合成路线(注明必要的反应条件 )___。
的合成路线(注明必要的反应条件 )___。