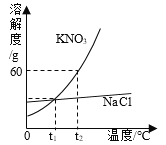
-
“ 改善环境质量,推动绿色发展” 是当前环保工作的重点。下列做法不符合这一要求的是
A. 燃放烟花爆竹,增添节日气氛 B. 提倡公交出行,减少尾气排放
C. 加强植树造林,改善空气质量 D. 垃圾分类回收,增强节约意识
难度: 中等查看答案及解析
-
下列变化中,属于化学变化的是
A. 冰雪融化 B. 大米霉变 C. 玻璃破碎 D. 酒精挥发
难度: 简单查看答案及解析
-
硅酸钠(Na2SiO3)溶液在建筑行业上可用作防腐剂与粘合剂,硅酸钠属于
A. 酸 B. 碱 C. 盐 D. 氧化物
难度: 简单查看答案及解析
-
下列物质由原子直接构成的是
A. 氯化钠 B. 水银 C. 酒精 D. 氧气
难度: 简单查看答案及解析
-
Cr2O3可以作某些化学反应的催化剂,其中Cr元素的化合价为
A. +1 B. +2 C. +3 D. +6
难度: 简单查看答案及解析
-
下列物质加入水中能形成溶液的是
A. 蔗糖 B. 汽油 C. 泥土 D. 生铁
难度: 简单查看答案及解析
-
为保证安全,面粉加工厂内应该张贴下列哪种标志
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列有关物质用途的叙述不正确的是
A. 活性炭:吸附异味 B. 氯化钠:常见的调味品
C. 烧碱:改良酸性土壤 D. 硫酸铜:可用于配农药波尔多液
难度: 简单查看答案及解析
-
下列有关实验现象的叙述正确的是
A. 镁条在空气中燃烧,产生大量黑色固体 B. NH4NO3溶于水时,放出热量,温度升高
C. 加碘食盐溶液中加入淀粉,溶液变蓝 D. 足量SO2通入稀高锰酸钾溶液中,溶液褪色
难度: 简单查看答案及解析
-
下列实验装置或操作正确的是
A.
保存氧气 B.
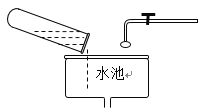 处理废弃药品
处理废弃药品C.
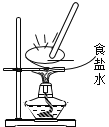 蒸发食盐水 D.
蒸发食盐水 D. 滴加试剂
难度: 简单查看答案及解析
-
Sb2O5是一种重要的阻燃剂,可利用物质X通过反应X+2H2O2=Sb2O5+2H2O获得。根据质量守恒定律,推断X的化学式为
A. SbO2 B. Sb2O3 C. HSbO3 D. H3SbO4
难度: 中等查看答案及解析
-
我国民间有端午节挂艾草驱虫辟邪的习俗,艾草中含有丰富的黄酮素(化学式为C15H10O2)。下列关于黄酮素的叙述正确的是
A. 黄酮素属于有机物 B. 黄酮素中碳、氢元素的质量比为3∶2
C. 黄酮素中含有氧分子 D. 黄酮素的相对分子质量为222 g
难度: 简单查看答案及解析
-
下列说法正确的是
A. pH<7的雨水称为酸雨 B. 用汽油洗去衣服上的油污是乳化作用
C. 铁钉在潮湿空气中易生锈 D. 煤、石油、乙醇是三大重要的化石燃料
难度: 简单查看答案及解析
-
如图是某化学反应前后分子变化的微观示意图,下列说法错误的是
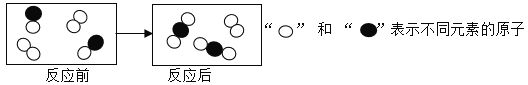
A. 图中共表示了4种物质 B. 该图表示的是一个化合反应
C. 化学反应中,原子发生重新组合 D. 化学反应前后,分子的种类一定发生改变
难度: 简单查看答案及解析
-
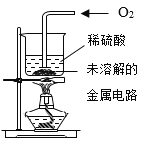
用下列实验装置进行相应实验,能达到实验目的的是
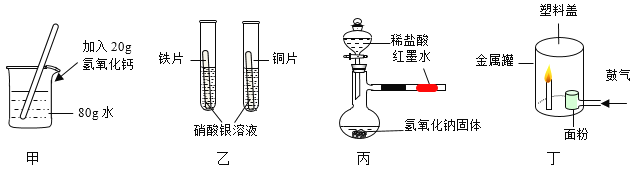
A. 用甲所示装置配制20%的Ca(OH)2溶液
B. 用乙所示装置验证铁、铜、银三种金属的活动性顺序
C. 用丙所示装置验证中和反应的热效应
D. 用丁所示装置验证面粉粉尘能发生爆炸
难度: 简单查看答案及解析
-
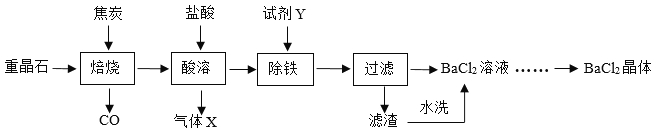
除去下列物质中的少量杂质,所选用试剂和主要操作均正确的是
序号
物质
杂质
试剂
主要操作
A
KNO3溶液
K2SO4
适量BaCl2溶液
过滤
B
O2
H2O
浓硫酸
洗气
C
FeCl2溶液
CuCl2
过量铁粉
结晶
D
NaCl溶液
MgCl2
过量NaOH溶液
过滤
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
利用如下装置进行实验,下列有关实验和结论正确的是

A. 缓慢通入N2,再加热Ⅰ处的碳酸氢铵,可观察到Ⅱ处红色石蕊试纸变成蓝色
B. 先缓慢通入CO2,再加热Ⅰ处炭粉,一定观察到Ⅱ处氧化铁粉末由红色变成黑色
C. 先缓慢通入空气,再加热Ⅰ处红磷,根据Ⅰ处燃烧而Ⅱ处红磷不燃烧说明可燃物燃烧一般需要与氧气接触
D. 先缓慢通入空气,再加热Ⅰ处8.00 g黄铁矿样品(主要成分为FeS2,杂质高温下不反应,反应方程式为:4FeS2 +11O2
2Fe2O3+8SO2),测得Ⅲ处碱石灰增重6.40 g,则ω(FeS2)= 75%
难度: 简单查看答案及解析