-
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
(提出问题)
从废旧手机中可以回收到哪些有价值的金属?如何回收?

(查阅资料)
Ⅰ.手机电路板中的金属及其价格如下表所示:
| 种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
| 市场价格/($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
| 矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
| 手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
(实验方案)
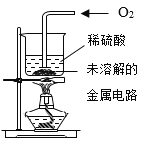
第一步:选择值得回收的金属。
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,
(1)原因是:①它们的市场价格较高;②_____。
第二步:设计实验分离、回收部分金属。
| 序号 | 实验步骤 | 实验现象 |
| Ⅰ | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
| Ⅱ | 将金属电路放入烧杯中,加入过量10%的稀盐酸浸泡 | …… |
| Ⅲ | 取Ⅱ中未溶解的金属电路,用蒸馏水洗净后,放入如上图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
| Ⅳ | 过滤Ⅲ中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
(问题讨论)
(2)由步骤I中的现象,可推知的焊锡的物理性质是_____(填字母)。
a.熔点低 b.硬度大 c.抗腐蚀性强
(3)步骤Ⅱ中实验室用溶质质量分数为37%、密度是1.18g•mL-1的浓盐酸配制10%的盐酸185g,需要浓盐酸_____ml;配制该稀盐酸应选择的量筒量程(水的密度为1g/cm3)为_____(填字母)。
a.10ml b.50ml c.100ml d.200ml
(4)步骤Ⅱ所得溶液中,至少含有_____(填数字)种溶质,该步骤中对应的实验现象是_____。
(5)请写出步骤Ⅲ中,溶液变成蓝色的化学方程式_____。
(6)步骤Ⅳ中过滤操作用到的玻璃仪器有玻璃棒、_____和_____,其中玻璃棒的作用是_____。
-
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
【提出问题】从废旧手机中可以回收到哪些有价值的金属?如何回收?
【查阅资料】
Ⅰ.手机电路板中的金属及其价格如下表所示:
| 种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
| 市场价格/($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
| 矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
| 手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
Ⅲ.2Cu + O2 + 2H2SO4 2CuSO4 + 2H2O
【实验方案】
第一步:选择值得回收的金属。
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:①它们的市场价格较高;②________________。
第二步:设计实验分离、回收部分金属。
| 序号 | 实验步骤 | 实验现象 |
| I | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
| II | 将金属电路放入烧杯中,加入过量稀盐酸浸泡 | …… |
| III | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如图所示装置中,进行实验。 
| 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
| IV | 过滤III中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
| V | …… | …… |
【问题讨论】
⑴ 由步骤I中的现象,可推知的焊锡的物理性质是________;
⑵ 步骤II对应的实验现象是________________;
⑶ 步骤II所得溶液中,至少含有溶质有______种;
⑷ 步骤V的操作是:“向步骤Ⅳ获得滤液中加入一定量铁粉”,若该实验过程加入铁粉前后溶液中主要离子变化示意图如图所示。

① 图中“ ”所代表微粒的符号为________;
”所代表微粒的符号为________;
② 充分反应后过滤,滤纸上固体物质是________(写化学式)。
-
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
(提出问题) 从废旧手机中可以回收到哪些有价值的金属?如何回收?
(查阅资料)
Ⅰ.手机电路板中的金属及其价格如下表所示:
| 种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
| 市场价格/($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
| 矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
| 手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:
Ⅰ.Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后; NiCl2溶液为绿色。
Ⅲ. 2Cu + O2 + 2H2SO4  2CuSO4 + 2H2O
2CuSO4 + 2H2O
(实验方案)
第一步:选择值得回收的金属。
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:
①它们的市场价格较高;②___________。
第二步:设计实验分离、回收部分金属。
| 序号 | 实验步骤 | 实验现象 |
| I | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
| II | 将金属电路放入烧杯中,加入过量稀盐酸浸泡 | …… |
| III | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如右图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
| IV | 过滤III中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
| V | …… | …… |
(问题讨论)
(1)由步骤I中的现象,可推知的焊锡的物理性质是__________;

(2)步骤II对应的实验现象是________;
(3)步骤II所得溶液中,至少含有溶质有________种;
(4)步骤V的操作是:“向步骤Ⅳ获得滤液中加入一定量铁粉”,若该实验过程加入铁粉前后溶液中主要离子变化示意图如右图所示。
① 图中“ ”所代表微粒的符号为__________;
”所代表微粒的符号为__________;
② 充分反应后过滤,滤纸上固体物质是__________(写化学式)。
-
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。

[提出问题]从废旧手机中可以回收到哪些有价值的金属?如何回收?
[查阅资料] I,手机电路板中的金属及其价格如下表所示:
| 种类 | Fe | Cu | Al | Ni (镍) | Au | Ag | Pd (钯) |
| 市场价格/ ( $/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7*107 | 7.6*105 | 2.7*107 |
| 矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
| 手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明: Fe、Cu、 A1、 Ni的含量用质量分数(%)表示,Au、 Ag、 Pd的含量的单位为“g/t”。
II. Ni的金属活动性位于氢前;Pd 的金属活动性位于氢后;NiCl2 溶液为绿色。
Ⅲ.
[实验方案]第一步:选择值得回收的金属。
依据资料I中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd, 原因是:①它们的市场价格较高;②__________________。
第二步:设计实验分离、回收部分金属。
| 序号 | 实验步骤 | 实验现象 |
| Ⅰ | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
| Ⅱ | 将金属电路放入烧杯中,加入过量稀盐酸浸泡 | _______________ |
| Ⅲ | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
| Ⅳ | 过滤Ⅲ中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
| Ⅴ | _______________ | _______________ |
[问题讨论]
(1)由步骤I中的现象,可推知的焊锡的物理性质是______________。
(2)步骤II对应的实验现象是______________。
(3)步骤II所得溶液中,一定含有的金属元素是____________。
(4)步骤V的操作是:“向步骤IV获得滤液中加入一定量铁粉”。若该实验过程加入铁粉前后溶液中主要离子变化示意图如图所示。

①图中“ ”所代表粒子的符号为_______________。
”所代表粒子的符号为_______________。
②充分反应后过滤,滤纸上固体物质是__________________(写化学式); .
③写出该反应的化学方程式_________________。
-
据统计,我国每年报废的手机超过1亿部,若不进行回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
【提出问题】 从废旧手机中可以回收到哪些有价值的金属?如何回收?
【查阅资料】
Ⅰ.手机电路板中的金属及其价格如下表所示:
| 种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
| 市场价格/($/t) | 3 6 5 | 7175.5 | 1710.5 | 1 4 2 3 5 | 4.7×107 | 7.6×105 | 2 . 7 × 1 0 7 |
| 矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
| 手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后; NiCl2溶液为绿色。
Ⅲ.2Cu + O2 + 2H2SO4  2CuSO4 + 2H2O
2CuSO4 + 2H2O
【实验方案】
第一步:选择值得回收的金属
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:
① _____________;②它们的市场价格较高。
第二步:设计实验分离、回收部分金属
| 序号 | 实验步骤 | 实验现象 |
| I | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
| II | 将金属电路放入烧杯中,加入过量稀盐酸浸泡 | …… |
| III | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
| IV | 过滤III中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
| V | …… | …… |
【问题讨论】
(1)由步骤I中的现象,可推知的焊锡的物理性质是____________。
(2)步骤II对应的实验现象有___________。
(3)步骤II所得溶液中,至少含有溶质有_____________种。
(4)步骤V的操作是:“向步骤Ⅳ获得滤液中加入一定量铁粉”,若该实验过程加入铁粉前后溶液中主要离子变化示意图如下图所示:

① 图中“ ”所代表微粒的符号为____________;
”所代表微粒的符号为____________;
② 充分反应后过滤,滤纸上固体物质是____________(写化学式)。
-
据统计,我国每年报废的手机超过 1 亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有 Sn、Fe、Cu、Au、Ag 等金属。如图是某工厂回收其中部分金属的流程图。( 假设流程图中各反应均恰好完全反应。已知: 2Cu+O2+2H2SO4 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)步骤②中产生的气体是_______ ;步骤②~⑤都涉及到的操作是_______ ,其中用到的金属仪器是 ____ 。滤渣 1 中含有的金属是____ (选填字母)。
A Cu、Sn、Au、Pd B Cu、Au、Ag、Pd
C Sn、Au、Ag、Pd D Cu、Sn、Au、Ag
(2)已知 Sn 的化合价为+2 价,则步骤③反应的化学方程式为________ 。
(3)步骤⑥回收的纯净物 B 是________ (写名称)。
-
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有Sn、Fe、Cu、Au、Ag等金属。如图是某工厂回收其中部分金属的流程图。(假设流程图中各反应均恰好完全反应。已知:2Cu+O2+2H2SO4 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)步骤②中产生的气体是_____;步骤②~⑤都涉及到的操作是_____,其中用到的金属仪器是_____。滤渣1中含有的金属是_____(选填字母)。
A Cu、Sn、Au B Cu、Au、Ag C Au、Ag D Cu、Sn、Au、Ag
(2)已知Sn的化合价为+2价,则步骤③反应的化学方程式为_____。步骤⑤的现象为_____。
(3)步骤⑥回收的纯净物B是_____(写名称)。
-
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有以下金属: Sn、Pb、 Fe、Cu、Au、Ag、Ni (镍,银白色)、Pd (钯,银白色)。如图是某工厂回收其中部分金属的流程图。( 假设流程图中各反应均恰好完全反应。已知: )
)

(1)步骤②中产生的气体的用途___________(写一种),滤渣2中含有的金属是_________。
(2)步骤⑤反应的化学方程式_____________。该反应属于________________。
(3)步骤③中检查铁粉是否足量的方法是_____________。
(4)金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是___________。
(5)步骤②中需要用到的玻璃仪器有____________。
-
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染.某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、Pd(钯,银白色).如图是某工厂回收其中部分金属的流程图.(假设流程图中各反应均恰好完全反应.已知:2Cu+O2+2H2SO4 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)步骤②中产生的气体是 .
(2)滤渣2中含有的金属是 .
(3)步骤⑤反应的化学方程式 .
(4)步骤⑥回收的纯净物B是 (写化学式).
(5)金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是 .

-
我国每年报废的手机超过1亿部。 废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。 化学兴趣小组为回收其中的铜,设计并进行了如下实验。 已知:Cu + H2O2+ H2SO4=CuSO4+ 2H2O;不考虑金、银发生类似反应。
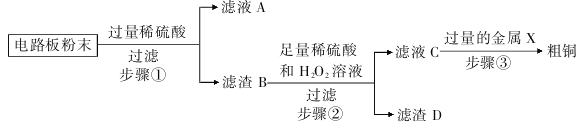
(1)进行过滤操作时应注意____________(写出一种即可)。
(2)滤液A中的阳离子有____________(填符号)。
(3)写出步骤①中发生反应的化学方程式 ____________(写一个),基本反应类型为____________ 。
(4)除去粗铜中的杂质,可选用____________(填字母序号)。
a. 磁铁b. 稀盐酸c. 蒸馏水d. 氯化铜溶液
















