-
在两个密闭容器中,分别充有质量相等的甲乙两种气体。若两容器的温度和压强均相等,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小
难度: 简单查看答案及解析
-
化学与环境保护、社会可持续发展密切相关,下列说法或做法合理的是
A. 进口国外电子垃圾,回收其中的贵重金属
B. 将地沟油回收加工为生物柴油,提高资源的利用率
C. 洗衣粉中添加三聚磷酸钠,增强去污效果
D. 大量生产超薄塑料袋,方便人们的日常生活
难度: 简单查看答案及解析
-
下列几种说法中正确的是
A. 摩尔是化学上常用的一个物理量
B. NaOH的摩尔质量是40g
C. 0.012kg 的C 含有约6.02×1023 个碳原子
D. 一个水分子的质量为
g
难度: 中等查看答案及解析
-
下列化学用语使用正确的是( )
A. F-的结构示意图
B. 纯碱的化学式:NaHCO3
C. 过氧化钙的化学式:CaO2 D. 硫酸铁的电离方程式:Fe2(SO4)3=Fe23++3SO42-
难度: 中等查看答案及解析
-
分类方法在化学学科的发展中起了非常重要的作用。下图1是某反应在密闭容器中反应前后的分子状况示意图,“
”和“
”分别表示不同的原子。对此反应的分类正确的

A. 化合反应 B. 分解反应
C. 复分解反应 D. 置换反应
难度: 中等查看答案及解析
-
下列关于胶体的说法正确的是
A.胶体的分散质粒子能通过滤纸,而其他分散系的分散质粒子不能通过滤纸
B.氢氧化铁胶体、硫酸铜溶液用激光笔照射,均能观察到一条光亮的通道
C.胶体区分于溶液的本质特征是胶体的分散质粒子直径在1nm~100nm之间
D.氢氧化铝和氢氧化铁胶体可用于净水是因为它们具有强氧化性
难度: 中等查看答案及解析
-
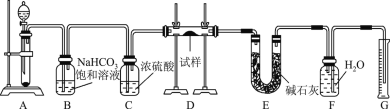
为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法正确的是
选项
物质
除杂试剂
分离方法
A
铜粉(铁粉)
稀盐酸
过滤
B
NaCl溶液(CuCl2)
NaOH溶液
萃取
C
乙醇(水)
________
分液
D
CO(HCl)
饱和NaHCO3溶液
洗气
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验操作或装置不正确的是
A. 蒸馏
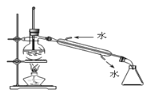 B. 过滤
B. 过滤
C. 萃取
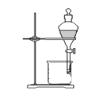 D. 蒸发
D. 蒸发
难度: 中等查看答案及解析
-
在澄清透明溶液中,下列离子组能大量共存的是( )
A. Ca2+、Na+、SO42-、Cl- B. Mg2+、Cu2+、SO42-、NO3-
C. NH4+、K+、OH-、Cl- D. OH-、HCO3-、NO3-、、K+
难度: 中等查看答案及解析
-
下列溶液中的c(Cl-)与50mL1mol·L-1 AlCl3溶液中的c(Cl-)相等的是
A. 150mL1mol·L-1 NaCl溶液 B. 75mL2mol·L-1 FeCl3溶液
C. 75mL2mol·L-1 BaCl2溶液 D. 150mL3mol·L-1 KCl溶液
难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-===Fe3O4+S4O62-+2H2O,下列说法中,不正确的是
A. x=4
B. 每生成1molFe3O4,反应转移的电子总数为3mol
C. 1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为0.25 mol
D. 可以通过丁达尔效应判断有无Fe3O4纳米颗粒生成
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 钠和水反应Na+H2O=Na++OH-+H2↑
B. 碳酸钙与稀盐酸反应:2H++CO32- = CO2↑+H2O
C. NaHCO3溶液与少量Ca(OH) 2溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D. 碳酸氢钠溶液中加入醋酸:HCO3-+ CH3COOH = CH3COO- + H2O + CO2↑
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列判断正确的是( )
A. 1L1mol·L-1KClO3溶液中含有的氯离子数目为NA
B. 标准状况下,22.4LH2O含有的分子数目为NA
C. 16gO2与16gO3含有的氧原子数目相等
D. 18gNH4+所含质子数为10NA
难度: 中等查看答案及解析
-
某混合物的水溶液,只可能含有以下离子中的若干:NH4+、Cl﹣、Mg2+、Ba2+、K+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.04mol;
③第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥,沉淀质量2.33g。
根据上述实验,以下推测正确的是( )
A. K+一定不存在 B. 该溶液中含CO32-的浓度为0.1 mol·L-1
C. Cl﹣可能存在 D. Ba2+一定不存在,Mg2+可能存在
难度: 中等查看答案及解析