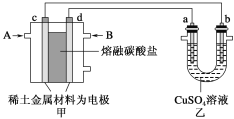
-
《本草纲目》中“石碱”一条记载:石碱出山东济宁诸处,彼人采篙寥之属,晒干烧灰,以水淋汁,久则凝淀如石,洗衣发面,亦去垢发面。这里的“石碱”是指
A. KOH B. KAl (SO4)2 C. KHCO3 D. K2CO3
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol OH- 含有的电子数目为10NA
B. 1mol Cl2溶于水,转移电子的数目为NA
C. 标准状况下,2.24 L CCl4含有的分子数目为0.1NA
D. 1L 1 mol·L-1 Na2CO3溶液中含有的CO32-数目为NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 碳酸钠可称为碳酸盐、钠盐或碱式盐
B. 鸡蛋清、浑浊的河水可能属于同一类别
C. 强光束通过Fe(OH)3胶体时发生了显著的化学变化
D. 直径为10-8 m的微粒一定属于胶体
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 水电离出的c(H+)·c(OH-)=10-22的溶液:K+、Na+、SO42-、S2O32-
B. 澄清透明溶液:Mg2+、Cu2+、Cl-、SO42-
C. 使酚酞变红色的溶液:NH4+、K+、AlO2-、NO3-
D. 含0.1mol·L-1 KI的溶液:Fe3+、Na+、NO3-、Cl-
难度: 中等查看答案及解析
-
把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H2的速率v与时间t的关系如下图所示,其中影响AB段速率的主要因素是
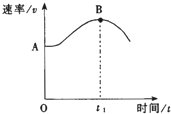
A. H+的浓度 B. 体系的压强 C. 溶液的温度 D. Cl-的浓度
难度: 中等查看答案及解析
-
在离子浓度都为0.1 mol·L-1的下列溶液中,加入(或通入)某物质后,发生反应的先后顺序正确的是
A. 在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+
B. 在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32-
C. 在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32-
D. 在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+
难度: 困难查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是
A. 向浓氨水中加入NaOH固体有利于NH3逸出
B. 对2HI(g)
H2(g)+I2(g) 平衡体系,减小容器体积,体系颜色变深
C. 可乐饮料打开瓶盖后有气泡冒出
D. 实验室用排饱和碳酸氢钠溶液的方法收集二氧化碳
难度: 中等查看答案及解析
-
氯酸是一种强酸,浓度超过40%时会发生分解,该反应可表示为aHClO3===bO2↑+cCl2↑+dHClO4+eH2O,下列有关说法不正确的是
A. 氧化性:HClO3>O2
B. 若a=8,b=3,则生成3 mol O2时转移20 mol电子
C. 若氯酸分解所得1 mol混合气体的质量为45 g,则反应方程式可表示为3HClO3===2O2↑+Cl2↑+HClO4+H2O
D. 由非金属性Cl>S,可推知酸性HClO3>H2SO4
难度: 中等查看答案及解析
-
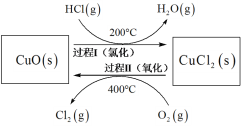
下列物质转化在给定条件下能实现的是
①
②
③
④
⑤
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
难度: 中等查看答案及解析
-
在稀硫酸中加入铜粉,铜粉不溶解,再加入某X物质,发现铜粉逐渐溶解,X不可能是
A. FeCl3 B. HNO3 C. HCl D. KNO3
难度: 中等查看答案及解析
-
汽车发动机稀燃控制系统主要工作原理是发动机在稀燃和富燃条件下交替进行,尾气中的NOx在催化剂上反应脱除。其工作原理示意图如下:

下列说法不正确的是
A. 稀燃过程中,NO发生的主要反应为:2NO + O2 === 2NO2
B. 稀燃过程中,NO2被吸收的反应为:BaO + 2NO2 === Ba(NO3)2
C. 富燃过程中,NO2被CO还原的反应为:2NO2 + 4CO === N2 + 4CO2
D. 富燃过程中,CxHy被O2氧化的反应为:CxHy + (x+y/4)O2 == xCO2 + y/2H2O
难度: 中等查看答案及解析
-
下列对有关实验事实的解释正确的是
A. 紫色高锰酸钾溶液中通入SO2后,溶液紫色褪去,说明SO2具有漂白性
B. 燃着的镁条在二氧化碳气体中剧烈燃烧,生成白色粉末和黑色固体,说明镁燃烧时不能用二氧化碳灭火
C. 铜和浓硝酸反应生成NO2,铜和稀硝酸反应生成NO,说明稀硝酸的氧化性比浓硝酸强
D. 氢气在氯气中安静地燃烧,发出苍白色火焰,说明氢气与氯气反应直接生成了挥发性的盐酸
难度: 中等查看答案及解析
-
下列实验事实不能得出相应结论的是
选项
实验事实
实验结论
A.
将浓硫酸滴到蔗糖表面,固体变黑膨胀,有刺激性气味的气体产生
浓硫酸有脱水性和强氧化性
B.
向滴有酚酞的Na2SO3溶液中加入BaCl2溶液,生成白色沉淀,红色褪去
Na2SO3溶液中存在水解平衡
C.
向某盐溶液中滴加浓NaOH溶液,加热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝
该溶液中含有NH4+
D.
测得某溶液的pH为7
该溶液为中性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在酸性KMnO4溶液中加入Na2O2粉末,溶液紫色褪去,其反应的离子方程式为:2MnO4−+16H++5Na2O2 === 2Mn2++5O2↑+8H2O+10Na+。下列说法正确的是
A. 通常用浓盐酸酸化KMnO4溶液
B. O2是还原产物,Mn2+是氧化产物
C. KMnO4溶液紫色褪去,说明Na2O2具有漂白性
D. 此反应产生22.4 L O2(标准状况下)时转移了2 mol e-
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 该组化合物中只含有共价键:H2O、NH4Cl、H2O2
B. 非金属原子间以共价键结合的物质都是共价化合物
C. Na2O、NaOH和Na2SO4为离子化合物,HCl、NH3、NH4NO3、H2SO4为共价化合物
D. 共价化合物是原子间通过共用电子对形成的
难度: 中等查看答案及解析
-
下列说法正确的是
①合成纤维和光导纤维都是新型无机非金属材料
②硅酸可制备硅胶,硅胶可用作袋装食品、瓶装药品的干燥剂
③Mg2+、H+、SiO32-、SO42-在水溶液中能大量共存
④向含K+、Na+、Br-、SiO32-的溶液中通入CO2后仍能大量共存
⑤SiO2不与任何酸反应,可用石英制造耐酸容器
⑥硅酸钠可制备木材防火剂,也可用于制备硅酸胶体
⑦Si→SiO2→H2SiO3均能一步转化
A. ①⑤⑥ B. ②⑥ C. ①②⑥⑦ D. ③④⑥
难度: 中等查看答案及解析
-
常温下,将Cl2缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol·L-1 NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述正确的是
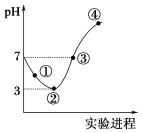
A. 曲线③④段有离子反应:HClO+OH-===ClO-+H2O
B. 可依据②处数据计算所溶解的n(Cl2)
C. ③处表示氯气与氢氧化钠溶液恰好反应完全
D. ①处c(H+)约为②处c(H+)的两倍
难度: 中等查看答案及解析
-
25 ℃时,将某一元碱MOH和盐酸溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,则下列判断不正确的是
实验
序号
c(盐酸)/
(mol·L-1)
c(MOH)/
(mol·L-1)
反应后溶
液的pH
甲
0.20
0.20
5
乙
0.10
a
7
A. 由实验甲可判断出MOH为弱碱 B. 将实验甲中所得溶液加水稀释后,c(H+)/c(M+)变小
C. a>0.10 D. MOH的电离平衡常数可以表示为Kb=10-8/(a-0.10)
难度: 中等查看答案及解析
-
常温下,向10 mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析正确的是
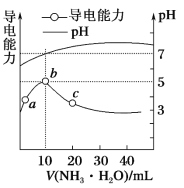
A. b~c溶液中所有离子浓度都减小
B. b点溶液pH=7,说明NH4R没有水解
C. c点溶液中存在c(R-) > c(NH4+)、c(H+)> c(OH-)
D. a~b导电能力增强,说明HR为弱酸
难度: 中等查看答案及解析
-
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如图所示:
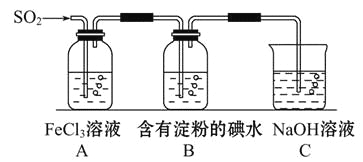
下列说法不合理的是( )
A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收SO2尾气,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀
D. 为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
难度: 困难查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是
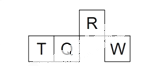
A. 最简单气态氢化物的热稳定性:R > Q
B. 最高价氧化物对应水化物的酸性:Q < W
C. 原子半径:T > Q > R
D. 含 T 的盐溶液一定显酸性
难度: 中等查看答案及解析
-
向两份等体积、等浓度,pH不同的FeSO4溶液中逐滴加入NaClO溶液,实验测得溶液pH随加入NaClO溶液体积变化曲线如下图,实验现象如下表。下列说法不正确的是
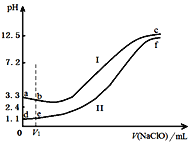
实验
实验现象
Ⅰ
滴入V1mL NaClO溶液产生大量红褐色沉淀
Ⅱ
滴入V1mL NaClO溶液,溶液变黄,未见沉淀,继续滴加出现红褐色沉淀
A. a~b段主要反应的离子方程式为:2Fe2+ + ClO-+5H2O===2Fe(OH)3↓+Cl-+4H+
B. d~e段主要反应的离子方程式为:2Fe2++2ClO-+3H+=== HClO + Cl-+ 2Fe3+ + H2O
C. c、f点pH接近的主要原因是:ClO-+ H2O
HClO + OH-
D. 向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出
难度: 中等查看答案及解析
-
T1 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
反应时间/min
n(CO)/mol
n(H2O)/mol
0
2.00
3.00
t1
0.80
t2
1.80
A. 用H2表示反应在t1 min内的平均速率为v(H2)=0.60/t1mol·L-1·min-1
B. 保持其他条件不变,若起始时向容器中充入3.00 mol CO和2.00 mol H2O(g),达到平衡时,n(CO2)=1.20 mol
C. 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO转化率将增大
D. 温度升至T2 ℃,上述反应的平衡常数为0.70,则正反应的ΔH<0
难度: 中等查看答案及解析