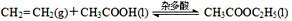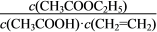-
Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。
(1)Cl2可与NaOH溶液反应制取消毒液,请写出消毒液中有效成分的电子式__________。
(2)实验室可用MnO2和浓盐酸反应制取Cl2,反应的化学方程式是____________________ 。
(3)工业上可采取电解饱和食盐水的方法制取Cl2,阳极的电极反应式为________________。
(4)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g) ∆H =-115.4 kJ•mol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
2Cl2(g) + 2H2O(g) ∆H =-115.4 kJ•mol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
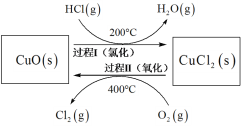
过程I的反应为:2HCl(g) + CuO (s)  CuCl2(s) + H2O(g) ∆H1 =-120.4 kJ•mol-1
CuCl2(s) + H2O(g) ∆H1 =-120.4 kJ•mol-1
①过程II反应的热化学方程式为_______。
②过程I流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氯化结束时溶液的现象为_______。
③相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为_______。
④实验测得在不同压强下,总反应的HCl平衡转化率(ɑHCl)随温度变化的曲线如图:
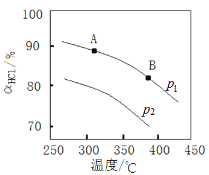
ⅰ.平衡常数比较:K(A)_____K(B) (填“>”“<”或“=”,下同)。
ⅱ.压强比较:p1_____ p2。
(5)以上三种制取Cl2的原理,其共同之处是_______。
-
氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式____。
(2)实验室常用MnO2与浓盐酸反应制备Cl2,装置如图所示:
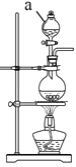
仪器a的名称为____。制备实验开始时,先检査装置气密性,接下来的操作依次是____(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图所示装置:
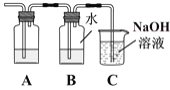
①装置A中应加入的试剂是____。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是____,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是____。
A.AgNO3溶液 B.石蕊试液 C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是____。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法____。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
-
(16分)氯元素是生产生活中常见的非金属元素
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式: 。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
① NaCl和Cl2中化学键的类型分别是 和 。
② 燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③ 已知:
2H2O2(l) === 2H2O(l)+O2(g) ΔH1=-196.46 kJ·mol-1
H2(g)+1/2O2(g) === H2O(l) ΔH2=-285.84 kJ·mol-1
Cl2(g)+H2(g) === 2HCl(g) ΔH3=-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
(4)工业上通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
完成Ⅰ中电解过程中阳极的反应式: 。
(5)一定条件下,在水溶液中1 mol Cl-、ClO-x(x=1,2,3,4)的能量(kJ)相对大小如下图所示。

①D是 (填离子符号)。
②B A+C反应的热化学方程式为 (用离子符号表示)。
A+C反应的热化学方程式为 (用离子符号表示)。
-
氯元素是生产生活中常见的非金属元素
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式: 。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a. 臭氧 b.NH3 c. 明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
① NaCl和Cl2中化学键的类型分别是 和 。
② 燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③ 已知:2H2O2(l) === 2H2O(l)+O2(g) ΔH1=-196.46 kJ·mol-1
H2(g)+1/2O2(g) === H2O(l) ΔH2=-285.84 kJ·mol-1
Cl2(g)+H2(g) === 2HCl(g) ΔH3=-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
(4)工业上通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
完成Ⅰ中电解过程中阳极的反应式: 。
-
乙酸是重要的化工原料,在生活、生产中被广泛应用。
(1)写出乙酸在水溶液中的电离方程式_______________________。若某温度下,CH3COOH(aq)与NaOH(aq)反应的焓变△H= - 46.8kJ·mol-1 ,HCl(aq)与NaOH(aq)反应的焓变△H= - 55.6 kJ·mol-1,则CH3COOH在水中电离的焓变△H=_________kJ·mol-1。
(2)已知常温下CH3COOH的电离常数K=1.6×10-5,该温度下,1 mol·L-1CH3COONa溶液pH约为________(已知lg2=0.3)。向pH=2的CH3COOH溶液中加入pH=2的稀硫酸溶液,保持溶液温度不变,溶液的pH将________________填“变大”或“变小”或“不变”)。
(3)常温下,向10 mL 0.1 mol·L-1的CH3COOH溶液中逐滴滴入0.1 mol·L-1的ROH溶液,所得溶液pH及导电性变化如图。下列分析正确的是_______。
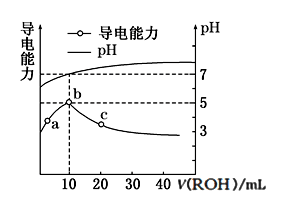
b点导电能力最强,说明ROH为强碱
b点溶液pH=5,此时酸碱恰好中和
C.c点溶液存在c(R+)>c(CH3COO-)、c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)·c(OH-)=KW=1.0×10-14
(4)近年来用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,具有明显经济优势。其合成的基本反应如下: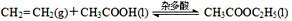
①在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是________。
A.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,说明反应已达到化学平衡
B.当体系中乙烯的百分含量保持不变,说明反应已达到化学平衡
C.达到化学平衡后再通入少量乙烯,再次达到化学平衡时,乙烯的浓度与原平衡相等
D.该反应的平衡常数表达式为K=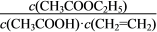
②乙烯与乙酸等物质的量投料条件下,某研究小组在不同压强下进行了在相同时间点乙酸 乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
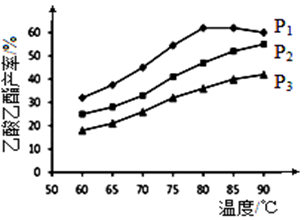
温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是__________________[用 (P1)、
(P1)、 (P2)、
(P2)、 (P3)分别表示不同压强下的反应速率]。在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________________________。根据测定实验结果分析,较适宜的生产条件是_________________(填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有___________________(任写出一条)。
(P3)分别表示不同压强下的反应速率]。在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________________________。根据测定实验结果分析,较适宜的生产条件是_________________(填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有___________________(任写出一条)。
-
氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 性,请写出工业上用氯气与NaOH溶液反应生产消毒剂NaClO的离子方程式 。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O和NaHCO3的离子方程式 。
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为 。
②ClO2遇浓盐酸会生成Cl2,每生成1 mol Cl2转移电子的物质的量为 。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为 。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4 mol HCl被氧化放出115.6 kJ的热量。
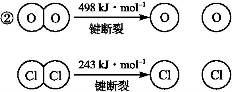
则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
-
(13分)钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如下:
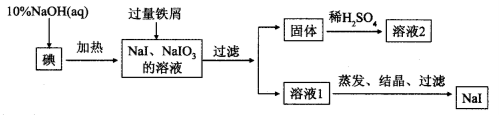
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中 与IO-的物质的量之比为1 :1,则该反应的离子方程式为______________。
与IO-的物质的量之比为1 :1,则该反应的离子方程式为______________。
(2)生产流程中加入过量铁屑的目的是_____________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________________________。
(3)溶液2中除含有H+外,一定含有的阳离子是_____________;试设计实验证实该金属阳离子的存在__________________________。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60 g草酸亚铁晶体(相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:
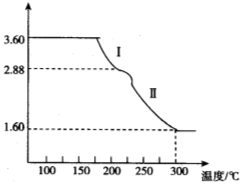
①分析图中数据,根据信息写出过程Ⅰ发生的化学方程式_______________________。
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式__________________。
-
氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途。
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为________。
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为________。
(3)下列措施能增强84消毒液杀菌能力的是________。
A.加入适量醋酸 B.加入适量亚硫酸 C.加入少量NaOH粉末
(4)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓度关系正确的是________。
A.c(Na+) + c(H+) = c(OH-) + c(Cl-)
B.c(Na+) = c(ClO-) + c(Cl-)
C.c(Na+) = 2c(ClO-) + c(HClO)
(5)84消毒液不能用于消毒钢铁(含Fe、C)制品,易发生电化学腐蚀,钢铁制品表面生成红褐色沉淀。正极反应为________。
-
钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如图所示:
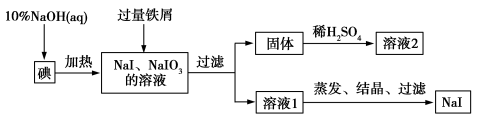
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO 与IO-的物质的量之比为1∶1,则该反应的离子方程式为 。
与IO-的物质的量之比为1∶1,则该反应的离子方程式为 。
(2)生产流程中加入过量铁屑的目的是__________________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是__________________。
(3)溶液2中除含有H+外,一定含有的阳离子是_______________;试设计实验证实该金属阳离子的存在:___________________。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60 g草酸亚铁晶体(相对分子质量是180)用热重法 对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:
对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:
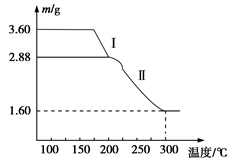
①分析图中数据,根据信息写出过程I发生的化学方程式:____________ ______。
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式:______________。
-
钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如图所示:
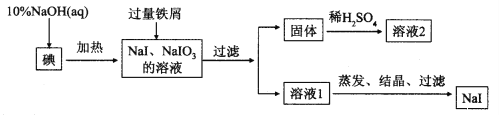
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为______________。
(2)生产流程中加入过量铁屑的目的是_____________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________________________。
(3)溶液2中除含有H+外,一定含有的阳离子是_____________;试设计实验证实该金属阳离子的存在__________________________。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60 g草酸亚铁晶体(相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:
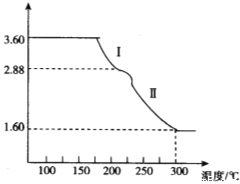
①分析图中数据,根据信息写出过程Ⅰ发生的化学方程式_______________________。
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式_________。
2Cl2(g) + 2H2O(g) ∆H =-115.4 kJ•mol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:

CuCl2(s) + H2O(g) ∆H1 =-120.4 kJ•mol-1



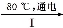 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体