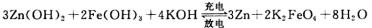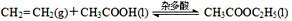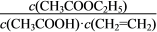-
氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式____。
(2)实验室常用MnO2与浓盐酸反应制备Cl2,装置如图所示:
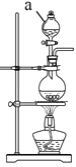
仪器a的名称为____。制备实验开始时,先检査装置气密性,接下来的操作依次是____(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图所示装置:
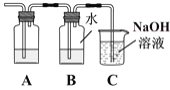
①装置A中应加入的试剂是____。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是____,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是____。
A.AgNO3溶液 B.石蕊试液 C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是____。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法____。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
-
氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途。
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为________。
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为________。
(3)下列措施能增强84消毒液杀菌能力的是________。
A.加入适量醋酸 B.加入适量亚硫酸 C.加入少量NaOH粉末
(4)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓度关系正确的是________。
A.c(Na+) + c(H+) = c(OH-) + c(Cl-)
B.c(Na+) = c(ClO-) + c(Cl-)
C.c(Na+) = 2c(ClO-) + c(HClO)
(5)84消毒液不能用于消毒钢铁(含Fe、C)制品,易发生电化学腐蚀,钢铁制品表面生成红褐色沉淀。正极反应为________。
-
氢氧化钠是一种用途十分广泛的重要化工原料。工业上主要通过电解氯化钠饱和溶液的方法获得氢氧化钠,我国的氯碱工业大多数采用离子交换膜电解槽。
(1)离子交换膜电解槽一般采用金属钛作阳极,其原因是
阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是________________________________________________________________________。
(2)为使电解氯化钠的速率加快,下列措施可行的是________。
a.增大阴极碳钢网的面积
b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离
d.提高电解时电源电压
(3)如果将某离子交换膜电解槽①电解时的电压增大到原来的2倍;②电解时的电流强度增大到原来的2倍;③电解时温度从30 ℃提高到60 ℃,则电解速率一定会达到原来2倍的是________。
-
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸的冶炼钢铁的重要原料。高温下可发生反应:其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
(2)氯化铝溶液显酸性,原因是_________________________(用离子方程式稀释);
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2;它易被氧化),原理如下图所示。
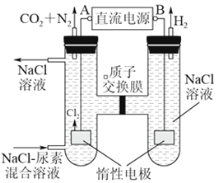
①电源的负极为_________(填“A”或“B”)。
②阳极室中发生的反应依次为_________、_________。
③电解结束后,阴极室溶液的pH与电解前相比将_________;若阴极共收集到气体6.72L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
(4)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•moL-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•moL-1
H2O(g)═H2O(l)△H=-44.0kJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:_________。
-
(14分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
3FeS2+8O2 6SO2+Fe3O4,该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
6SO2+Fe3O4,该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
(2)氯化铁溶液显酸性,原因是___________________________(离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:___________________________。
(3)K2FeO4可作为一种“绿色高效多功能”水处理剂。原因是 。目前,人们针对K2FeO4的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物K2FeO4水溶液稳定性的是
A.亚硫酸钠 B.KOH C.醋酸 D.Fe(NO3)3
(4)K2FeO4与Zn组成新型二次电池高铁电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH  3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
放电时电池的负极反应式为_______;充电时电解液的pH________(填“增大”“减小”或“不变”之一)。
-
(10分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
3FeS2+8O2 6SO2+Fe3O4
6SO2+Fe3O4
该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
(2)氯化铁溶液显酸性,原因是___________________(用适当的文字和离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:____________________________________。
(3)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
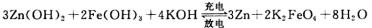
放电时电池的负极反应式为____________________;充电时电解液的pH________(填“增大”“减小”或“不变”之一)。
-
乙醇是一种重要的化工原料,在生活、生产中的应用广泛。
(1)工业上利用二甲醚合成乙醇
反应①:CH3OCH3(g) + CO(g)  CH3COOCH3(g) △H1
CH3COOCH3(g) △H1
反应②:CH3COOCH3(g) + 2H2(g)  CH3OH(g) + C2H5OH(g) △H2
CH3OH(g) + C2H5OH(g) △H2
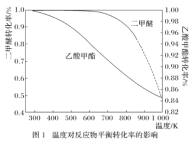
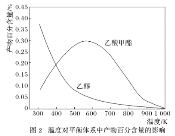
一定压强下,温度对二甲醚和乙酸甲酯平衡转化率影响如下图1所示,据图示判断,△H2________0(填“>”或“<”)。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如下图2所示。在300K~600K范围内,乙酸甲酯的百分含量逐渐增加,而乙醇的百分含量逐渐减小的原因是_____________。
(2)乙醇加入汽油(平均分子式为C8H18)中能改善油品质量,减少对环境的影响。
①乙醇汽油可提高燃油的燃烧效率,减少CO等不完全燃烧产物的生成。相同条件下,等物质的量的乙醇与汽油完全燃烧消耗氧气之比为_____________。

②NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag−ZSM−5为催化剂,测得NO转化为N2的转化率随温度变化情况如上图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____________;在 =1的条件下,应控制的最佳温度在_____________左右,写出此条件下发生反应的化学方程式_____________。
=1的条件下,应控制的最佳温度在_____________左右,写出此条件下发生反应的化学方程式_____________。
(3)某乙醇燃料电池采用碱性介质,该电池工作时负极的电极反应式为____________。
-
乙醇是一种重要的化工原料,在生活、生产中的应用广泛。
(1)工业上利用二甲醚合成乙醇
反应①:CH3OCH3(g) + CO(g) CH3COOCH3(g) △H1
CH3COOCH3(g) △H1
反应②:CH3COOCH3(g) + 2H2(g) CH3OH(g) + C2H5OH(g) △H2
CH3OH(g) + C2H5OH(g) △H2
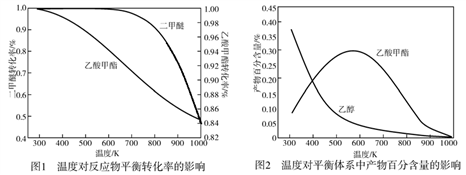
一定压强下,温度对二甲醚和乙酸甲酯平衡转化率影响如图所示,则△H1
_____________0(填“>”或“<”,下同)、△H2_____________0。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图所示。在300 K~600 K范围内,乙酸甲酯的百分含量逐渐增加,乙醇的百分含量逐渐减小的原因是_____________。
(2)乙醇加入汽油(平均分子式为C8H18)中能改善油品质量,减少对环境的影响。
①乙醇汽油可提高燃油的燃烧效率,减少CO等不完全燃烧产物的生成。相同条件下,等物质的量的乙醇与汽油完全燃烧消耗氧气之比为_____________。
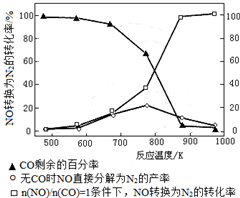
②NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag−ZSM−5为催化剂,测得NO转化为N2的转化率随温度变化情况如右图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____________;在 =1的条件下,应控制的最佳温度在_____________左右。写出此条件下发生反应的化学方程式:_____________。
=1的条件下,应控制的最佳温度在_____________左右。写出此条件下发生反应的化学方程式:_____________。
(3)某乙醇燃料电池采用质子(H+)溶剂,在200℃左右供电的电池总反应为C2H5OH+3O2  2CO2+3H2O。该电池负极的电极反应式为_____________。
2CO2+3H2O。该电池负极的电极反应式为_____________。
-
乙酸是重要的化工原料,在生活、生产中被广泛应用。
(1)写出乙酸在水溶液中的电离方程式_______________________。若某温度下,CH3COOH(aq)与NaOH(aq)反应的焓变△H= - 46.8kJ·mol-1 ,HCl(aq)与NaOH(aq)反应的焓变△H= - 55.6 kJ·mol-1,则CH3COOH在水中电离的焓变△H=_________kJ·mol-1。
(2)已知常温下CH3COOH的电离常数K=1.6×10-5,该温度下,1 mol·L-1CH3COONa溶液pH约为________(已知lg2=0.3)。向pH=2的CH3COOH溶液中加入pH=2的稀硫酸溶液,保持溶液温度不变,溶液的pH将________________填“变大”或“变小”或“不变”)。
(3)常温下,向10 mL 0.1 mol·L-1的CH3COOH溶液中逐滴滴入0.1 mol·L-1的ROH溶液,所得溶液pH及导电性变化如图。下列分析正确的是_______。
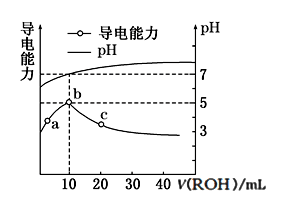
b点导电能力最强,说明ROH为强碱
b点溶液pH=5,此时酸碱恰好中和
C.c点溶液存在c(R+)>c(CH3COO-)、c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)·c(OH-)=KW=1.0×10-14
(4)近年来用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,具有明显经济优势。其合成的基本反应如下: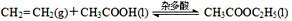
①在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是________。
A.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,说明反应已达到化学平衡
B.当体系中乙烯的百分含量保持不变,说明反应已达到化学平衡
C.达到化学平衡后再通入少量乙烯,再次达到化学平衡时,乙烯的浓度与原平衡相等
D.该反应的平衡常数表达式为K=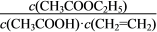
②乙烯与乙酸等物质的量投料条件下,某研究小组在不同压强下进行了在相同时间点乙酸 乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
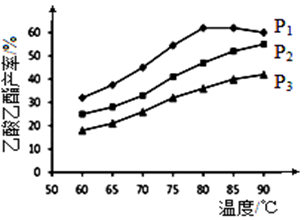
温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是__________________[用 (P1)、
(P1)、 (P2)、
(P2)、 (P3)分别表示不同压强下的反应速率]。在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________________________。根据测定实验结果分析,较适宜的生产条件是_________________(填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有___________________(任写出一条)。
(P3)分别表示不同压强下的反应速率]。在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________________________。根据测定实验结果分析,较适宜的生产条件是_________________(填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有___________________(任写出一条)。
-
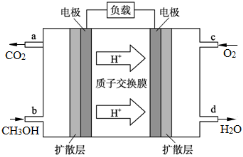
(14分)甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。已知:
光催化制氢:2H2O(l)===2H2(g)+O2(g) ΔH=+571.5 kJ/mol ①
H2与CO2耦合反应:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol ②
则反应:2H2O(l)+CO2(g) = CH3OH(l)+3/2O2(g)的ΔH= kJ/mol。
你认为该方法需要解决的技术问题有 (填字母)。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
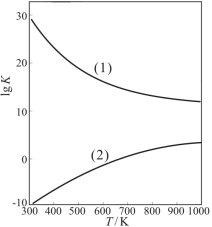
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应 (填“I”或“II”。下同)制甲醛的原子利用率更高。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。
②下图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示的是反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式: 。
(4)甲醇燃料电池的工作原理如图所示,则该电池负极的电极反应式为 。