-
化学与材料、生活和环境密切相关。下列有关说法中错误的是
A. 新型材料聚酯纤维、光导纤维都属于有机高分子
B. 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
C. 大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放
D. 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
难度: 简单查看答案及解析
-
下列有关化学用语使用错误的是( )
A. 氯化铵的电子式:
B. 原子核内有8个中子的碳原子:
C. 钾离子结构示意图:
D. 二氧化碳的电子式:
难度: 简单查看答案及解析
-
下列各组中的两种物质作用,反应条件或反应物的用量改变时,对生成物没有影响的是
A. NaOH与 CO2 B. Na2O2 与CO2 C. NaOH与AlCl3 D. Na与O2
难度: 中等查看答案及解析
-
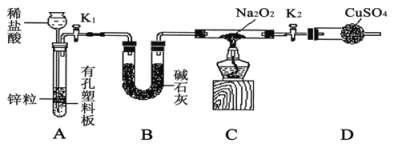
下列装置能达到实验目的是( )
A.
 B.
B. 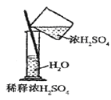 C.
C. 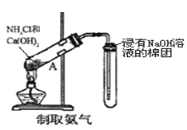 D.
D. 
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 硫酸铜溶液中加过量的氨水:Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+
B. 用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+==Ca2++CO2↑+H2O
C. 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O
C6H5OH+HCO3-
D. 用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I -+2H+==NO↑+I2+H2O
难度: 中等查看答案及解析
-
某溶液中加入铝粉能产生氢气,在该溶液中一定不能大量共存的离子组是( )
A. Na+、K+、Cl-、ClO- B. Cu2+、Fe2+ 、NO3-、SO42-
C. Na+、K+、Cl+、SO42- D. K+、 NH4+、 Cl-、SO42-
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法中一定正确的是( )
A. 1 L l mol·L-1的FeCl3溶液中含有NA个Fe3+
B. 4.8g镁与足量盐酸反应时,转移0.2 NA个电子
C. 钠与水反应生成1.12LH2,反应中转移的电子数为0.1NA
D. 常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3NA
难度: 中等查看答案及解析
-
下列有关结构和性质的说法中,正确的是( )
A. 酸性:HCl>H2S,所以,非金属性:Cl>S
B. 元素原子的最外层电子数越多,越容易得电子,非金属性越强
C. 同周期主族元素的原子形成的简单离子电子层结构相同
D. 同周期第ⅡA族与第IIIA族的元素原子序数之差不一定为1
难度: 中等查看答案及解析
-
已知:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O;MnO2+4HCl=MnCl2+Cl2↑+2H2O 其中,KMnO4和一般浓度的盐酸反应,K2Cr2O7需和较浓的盐酸(>6 mol·L-1)反应,MnO2需和浓盐酸(>8 mol·L-1)反应。以下结论中,不正确的是( )
A. 上述反应既属于氧化还原反应,又属于离子反应
B. 生成1 mol Cl2转移电子数均为2 NA(NA为阿伏加德罗常数)
C. 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2
D. 盐酸的浓度越大,Cl-的还原性越强
难度: 中等查看答案及解析
-
下列除去杂质的方法正确的是( )
A. 除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B. 除 CO2中的少量HCl:通入饱和Na2CO3溶液,收集气体
C. 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D. 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
难度: 中等查看答案及解析
-
常温下,将等浓度的FeSO4和(NH4)2SO4两种浓溶液混合可制得一种晶体,该晶体(称摩尔盐)是分析化学中常用的一种还原剂,其强热分解反应化学方程式:2(NH4)2Fe(SO4)2·6H2O
Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O。下列说法正确的是( )
A. 该反应中氧化产物是N2、NH3,还原产物是SO2、Fe2O3
B. 1mol摩尔盐强热分解时转移电子的物质的量为8NA
C. 向摩尔盐溶液中滴入足量浓NaOH溶液,最终可得刺激性气体和红褐色沉淀
D. 常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4大
难度: 中等查看答案及解析
-
向100 mL 0.250 mol/L的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是
A. 2.30 g B. 3.45g C. 1.15 g D. 0.575 g
难度: 简单查看答案及解析
-
向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )
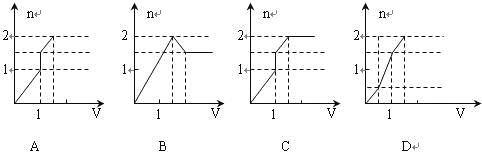
难度: 简单查看答案及解析
-
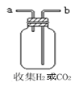
如图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
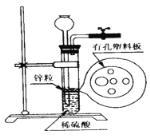
①食盐水②KNO3溶液 ③适量硫酸铜溶液④Na2CO3溶液 ⑤CCl4 ⑥浓氨水
A. ①②④ B. ②⑥
C. ②③⑤ D. ①③⑤
难度: 简单查看答案及解析
-
一定量的铁与一定量的浓HNO3反应, 得到硝酸铁溶液和NO2、 N2O4、 NO的混合气体,这些气体与3.36 L O2(标准状况)混合后通入水中, 所有气体完全被水吸收生成硝酸。若向所得硝酸铁溶液中加入2 mol•L-1 的NaOH溶液至Fe3+ 恰好沉淀,则消耗NaOH溶液的体积是( )
A. 150 mL B. 300 mL C. 120 mL D. 90 mL
难度: 困难查看答案及解析
-
已知:NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O=Na2CO3•nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品A 9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)
盐酸体积(mL)
8
15
20
50
x
120
150
生成CO2体积(mL)
0
112
224
896
2240
2240
2240
下列说法中不正确的是( )
A. x的最小值为100
B. x的最小值为110
C. 所加盐酸物质的量浓度为1.0mol/L
D. 样品A中NaHCO3和Na2CO3·nH2O的物质的量分别为0.090mol和0.010mol
难度: 困难查看答案及解析