-
化学与生产、生活密切相关,下列说法正确的是
A. 淀粉溶液、豆浆、雾和饱和食盐水均可发生丁达尔现象
B. 氮化硅(Si3N4)、氧化铝(Al2O3)、碳化硅(SiC)和二氧化锆(ZrO2)都可用作制高温结构陶瓷的材料
C. 绿色化学的核心是利用化学原理治理环境污染
D. 光化学烟雾、臭氧空洞、温室效应、酸雨(硝酸型)的形成都与氮氧化物有关
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X、W同主族,Y、Z同周期,X、Y、Z三种元素形成一种化合物M,25℃时0.1 mol/L的M溶液中c(OH-)/c(H+)=1.0×10-12,下列说法正确的是
A. 114号元素鈇(Fl)与Y在同一主族
B. X分别与Z、W形成的化合物中,含化学键类型相同
C. Z与X、W均可形成具有漂白性的化合物
D. X、Y形成的化合物中只含有极性共价键
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. Fe(OH)3溶于氢碘酸:Fe(OH)3+ 3H+=Fe3++ 3H2O
B. 用醋酸除去水垢:CaCO3+2H+=Ca2++ H2O+CO2↑
C. 氯气与水的反应:Cl2+H2O=2H++Cl—+ClO—
D. 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++HCO3—+OH—=CaCO3↓+H2O
难度: 简单查看答案及解析
-
下列说法正确的是
A. 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离
B. 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
C. 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中一定存在SO42-或SO32-
D. 提纯混有少量硝酸钾的氯化钠固体,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列叙述中正确的是
A. 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
B. 向含有FeI2的溶液中通入适量Cl2,当有1molFe2+被氧化时,该反应转移的电子数为3NA
C. 标准状况下,6. 72 L NO2与水充分反应转移的电子数目为0.3NA
D. 200g 46%的乙醇水溶液中,含H-O键的数目为2NA
难度: 中等查看答案及解析
-
下列各项中的实验方案不能达到预期实验目的的是
选项
实验目的
实验方案
A
鉴别BaCl2、Ba(NO3)2、Na2SiO3
三种盐溶液
分别向三种盐溶液中缓慢通入SO2气体
B
除去CuCl2溶液中的少量FeCl3
加入足量氧化铜粉末。充分反应后过滤
C
除去HCl气体中混有少量Cl2
将气体依次通过饱和食盐水、浓硫酸
D
配制氯化铁溶液
将氯化铁固体溶解在较浓的盐酸中再加水稀释
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
处理超标电镀废水,使其NaCN含量低于0.5 mg/L,即可达到排放标准,反应分两步进行。第一步NaCN与NaClO反应,生成NaOCN和NaCl。第二步NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。已知HCN是弱酸,易挥发,有剧毒;HCN、HOCN中N元素的化合价相同。下列说法正确的是
A. 处理NaCN超标电镀废水的过程中无元素化合价的改变
B. 第一步反应溶液应调节为酸性,可避免生成有毒物质HCN
C. 第二步发生的反应为2OCN- + 3ClO-
2CO2↑ + CO32− + 3Cl- + N2↑
D. 处理100 m3含NaCN 10.3 mg/L的废水实际至少需要50 mol NaClO
难度: 困难查看答案及解析
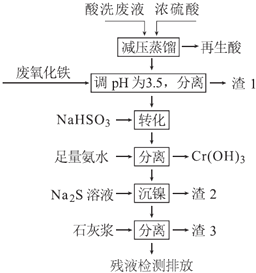
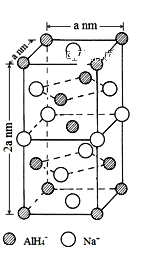


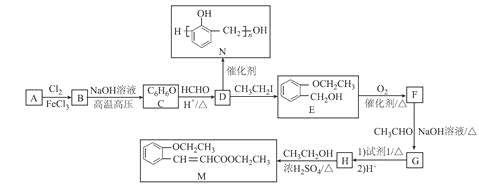

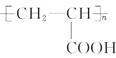 )的合成路线:________。
)的合成路线:________。