-
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是其电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
A. Y元素的最高价氧化物的水化物化学式为H2YO4
B. 它们形成的简单离子半径:X>W
C. X、Z两种元素的气态氢化物稳定性:Z>X
D. X与W形成的化合物中阴、阳离子个数比为1:1或1:2
难度: 中等查看答案及解析
-
下列说法正确的是
A. SO2可以用来漂白纸浆、毛、丝、草帽辫,增白食品等
B. 糖类、油脂和蛋白质在一定条件下都能水解
C. 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D. 高锰酸钾溶液、次氯酸钠溶液、双氧水都能杀菌消毒,这是利用他们的强氧化性
难度: 简单查看答案及解析
-
下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是
选项
条件
离子组
离子共存判断及反应的离子方程式
A
滴加氨水
Na+、Al3+、Cl-、NO3-
不能大量共存,Al3++3OH-=Al(OH)3↓
B
由水电离出的H+浓度为1×10-12mol•L-1
NH4+、Na+、NO3-、Cl-
一定能大量共存
NH4++H2O⇌NH3•H2O+H+
C
pH=1的溶液
Fe2+、Al3+、SO42-、MnO4-
不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
D
通入少量SO2气体
K+、Na+、ClO-、SO42-
不能大量共存,2ClO-+SO2+H2O=2HClO+SO32-
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列实验操作对应的实验现象及解释或结论都正确的是( )
选项
实验操作
实验现象
解释或结论
A
向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液
溶液变为黄色
氧化性:H2O2>Fe3+
B
向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液
先产生白色沉淀,然后产生蓝色沉淀
Ksp[Cu(OH)2]
>Ksp[Mg(OH)2]
C
将充满NO2的密闭玻璃球浸泡在热水中
红棕色变深
2NO2(g)
N2O4(g) ΔH<0
D
向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH)
溶液紫色褪去
乙二醇被氧化为乙二酸
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列关于电解质溶液的叙述正确的是
A. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
B. 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C. 在pH相同的盐酸和氯化铵溶液中水的电离程度相同
D. pH=11的NaOH溶液与pH=3醋酸溶液等体积混合,滴入石蕊溶液呈红色
难度: 中等查看答案及解析
-
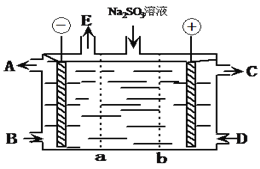
以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )
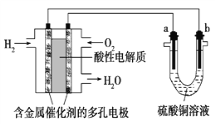
A. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
C. 电解过程中SO42— 移向b极
D. a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
难度: 中等查看答案及解析
-
常温下,向20ml,0.1mol·L-1CH3COOH溶液中滴加0.1mol·L-1的NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是
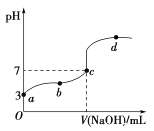
A. c点表示CH3COOH和NaOH恰好反应完全
B. a点表示的溶液中由水电离出的H+浓度为1.0×10-11mol·L-1
C. b点表示的溶液中c(CH3COO-)>c(Na+)
D. b、d点表示的溶液中[c(CH3COO-)•c(H+)]/c(CH3COOH)相等
难度: 困难查看答案及解析
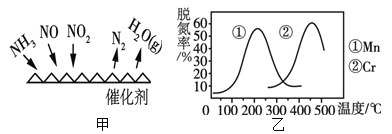
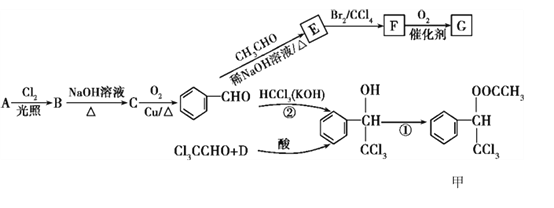
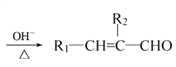 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)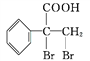 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以