-
化工生产中常用的“三酸两碱”是指:盐酸、硫酸、硝酸、烧碱和纯碱。在运输浓硫酸的储罐车上所贴的标识是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
纯净的二氧化硅可用于制造光导纤维。二氧化硅属于( )
A. 酸 B. 碱 C. 盐 D. 氧化物
难度: 中等查看答案及解析
-
下列物质中,属于电解质的是( )
A. 硫酸铜溶液 B. 干冰 C. 熔融的烧碱 D. 铁丝
难度: 中等查看答案及解析
-
下列物质用激光笔照射,不能在其内部形成一条光亮的“通路”的是 ( )
A. FeCl3溶液 B. 牛奶 C. 淀粉溶液 D. 雾
难度: 中等查看答案及解析
-
下列物质的电离方程式书写正确的是( )
A. FeSO4=Fe3++SO42— B. Ca(OH)2=Ca2++2(OH)—
C. H2SO4= 2H++ SO42— D. KClO3=K++Cl—+O2—
难度: 中等查看答案及解析
-
胶体和溶液的特征区别是( )
A. 胶体属于介稳体系 B. 胶体粒子的大小在1nm~100nm之间
C. 胶体具有丁达尔效应 D. 胶体粒子不能透过滤纸
难度: 中等查看答案及解析
-
容量瓶上不必标注的是 ( )
A. 刻度线 B. 容积 C. 物质的量浓度 D. 温度
难度: 简单查看答案及解析
-
化学上常用下图表示基本反应类型与氧化还原反应关系,其中阴影部分可以表示 ( )
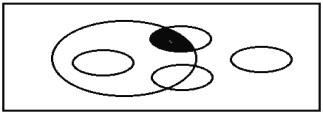
A. 置换反应 B. 复分解反应 C. 所有的分解反应 D. 有电子转移的化合反应
难度: 中等查看答案及解析
-
下列化学实验操作中,没有错误的是 ( )
A. 闻气体气味
 B. 点燃酒精灯
B. 点燃酒精灯
C. 过滤
 D. 移开蒸发皿
D. 移开蒸发皿
难度: 中等查看答案及解析
-
某溶液中存在大量的H+、Cl一、SO42一,该溶液中还可能大量存在的是
A. HCO3一 B. Ba2+ C. Al3+ D. Ag+
难度: 中等查看答案及解析
-
下列实验方法不能达到实验目的的是( )
A. 用燃着的木条证明二氧化碳气体没有助燃性
B. 用分液漏斗分离水与乙醇的混合物
C. 用盐酸鉴别碳酸钠溶液与硫酸钠溶液
D. 用排水集气法收集氢气
难度: 中等查看答案及解析
-
下列反应中,不属于氧化还原反应的是 ( )
A. Na2SiO3+2HCl=2NaCl+H2SiO3↓
B. Fe+CuSO4=Cu+FeSO4
C. 4NH3+5O2
4NO+6H2O
D. 2Mg+O2+2H2O = 2Mg (OH)2
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 钠与水反应:Na +2H2O = Na++ 2OH—+ H2↑
B. 锌粒与稀盐酸反应:Zn + 2H+ = Zn2+ + H2↑
C. 氢氧化铜与稀硫酸反应:OH—+ H+=H2O
D. CaCO3与HNO3反应:CO32-+2H+ = H2O + CO2↑
难度: 中等查看答案及解析
-
等质量的下列气体,在相同的状况下,所占体积最大的是 ( )
A. NH3 B. H2S C. Cl2 D. CH4
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数的值。下列判断正确的是 ( )
A. 28g N2含有的氮原子数目为NA
B. 1L 1mol·L—1K2CO3溶液中含有的钾离子数目为2NA
C. 常温常压下,11.2LO2中含有的原子数目为NA
D. 标准状况下,22.4L H2O含有的分子数目为NA
难度: 中等查看答案及解析
-
下列溶液中c(Cl—)与120mL2mol·L—1KCl溶液中c(Cl—)相等的是 ( )
A. 60mL1mol·L—1MgCl2溶液 B. 60mL2mol·L—1ZnCl2溶液
C. 40mL2mol·L—1AlCl3溶液 D. 480mL1mol·L—1NaCl溶液
难度: 中等查看答案及解析
-
100mL密度为1.84g/cm3,质量分数为98%的浓硫酸中,c(H2SO4)是( )
A. 18.4 B. 9.8mol·L—1 C. 1.84mol·L—1 D. 18.4mol·L—1
难度: 中等查看答案及解析
-
下列实验事故的处理方法不正确的是 ( )
A. 不慎将酒精灯碰翻,酒精在实验台上燃烧起来,应用湿抹布盖灭。
B. 少量的酸或碱的溶液滴在实验台上,应用大量水冲洗,再用抹布擦干。
C. 不慎将少量碱溶液溅入眼中,应立即用大量水冲洗,边洗边眨眼睛。
D. 较多的酸沾到皮肤上,应立即用大量的水冲洗,在涂上3%~5%的NaHCO3溶液
难度: 中等查看答案及解析
-
高铁的快速发展方便了人们的出行。工业上利用铝热反应焊接钢轨间的缝隙。反应的方程式如下:2Al+Fe2O3
2Fe+Al2O3,下列说法不正确的是( )
A. 氧化剂是Fe2O3,氧化产物是 Al2O3。
B. 被氧化的元素是铝,被还原的元素是铁。
C. 当转移的电子为0.3mol时,参加反应的铝为2.7g
D. Fe2O3既不是氧化剂又不是还原剂
难度: 中等查看答案及解析
-
实验室需配制480mL1mol·L—1的硫酸铜溶液,下列说法不正确的是 ( )
A. 应选用500mL的容量瓶
B. 应称取80.0gCuSO4
C. 应称取120.0gCuSO4·5H2O
D. 应称取125.0gCuSO4·5H2O
难度: 困难查看答案及解析