-
下列变化中属于吸热反应的是
①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释 ④Ba(OH)2·8H2O与NH4Cl反应 ⑤生石灰跟水反应生成熟石灰
A. ①④ B. ②③ C. ①④⑤ D. ②④
难度: 简单查看答案及解析
-
已知H—H键能为436 kJ·mol-1,H—N键能为391 kJ·mol-1,根据化学方程式:N2 + 3H2 = 2NH3 ΔH = -92.4 kJ·mol-1,则N≡N键的键能是( )
A. 431 kJ·mol-1 B. 946 kJ·mol-1
C. 649 kJ·mol-1 D. 869 kJ·mol-1
难度: 中等查看答案及解析
-
下列根据热化学方程式得出的结论正确的是
A. 已知H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ/mol,则稀H2SO4和稀Ba(OH)2溶液反应生成2 mol H2O(l)的反应热△H=﹣2×57.3 kJ/mol
B. 已知S(s)+ 3/2 O2(g)═SO3(g)△H=-395.7 kJ/mol,则硫磺的燃烧热为395.7 kJ/mol
C. 已知C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则金刚石比石墨稳定
D. 已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,则H2的燃烧热为△H=-285.8 kJ/mol
难度: 简单查看答案及解析
-
某反应CH3OH(l)+NH3(g) =CH3NH2(g)+H2O(g)在高温度时才能自发进行,则该反应过程的△H、△S判断正确的是
A. △H > 0、△S < 0 B. △H < 0、△S > 0
C. △H < 0、△S < 0 D. △H > 0、△S > 0
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 铁片与稀盐酸制取氢气时,加入Na2SO4固体或NaNO3固体都不影响生成氢气的速率
B. 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
C. 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大
D. 升高温度后,吸热反应的速率加快,放热反应的速率减慢
难度: 中等查看答案及解析
-
下列物质按纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是
A. 纯盐酸、水煤气、硫酸、醋酸、干冰
B. 冰醋酸、玻璃、硫酸钡、氢氟酸、乙醇
C. 油酯、冰水混合物、苛性钠、氢硫酸、三氧化硫
D. 绿矾、漂白粉、次氯酸、氯化钾、氯气
难度: 简单查看答案及解析
-
反应A(g) + 3B(g)
2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:①v(A)=0.45mol·L—1·min—1 ② v(B)=0.6mol·L-1·s-1 ③v(C)=0.4mol·L-1·s-1 ④v(D) =0.45mol·mol·L—1·min—1,该反应进行的快慢顺序为
A. ①>③=②>④ B. ①>②=③>④
C. ②>①=④>③ D. ④>②=③>①
难度: 中等查看答案及解析
-
一定能在下列溶液中大量共存的离子组是
A. 常温,pH=2的溶液中:Na+、NH4+、HCO3-、Br-
B. 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32-
C. 0.1 mol/L的NaNO3溶液中:H+、Fe2+、Cl-、SO42-
D. 水电离产生的H+浓度为1×10-12mol·L-1的溶液:NH4+、Na+、Cl-、CO32-
难度: 中等查看答案及解析
-
向某氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列实验符合要求的是
A. 滴定管洗净后注入标准液进行滴定,用去标准液21.70mL
B. 用托盘天平称量25.20g NaCl
C. 用玻璃棒蘸取溶液滴在表面皿上湿润的广泛pH试纸上测得其pH为12
D. 若25 mL滴定管中液面的位置在刻度为10mL处,则滴定管中液体的体积一定大15 mL
难度: 中等查看答案及解析
-
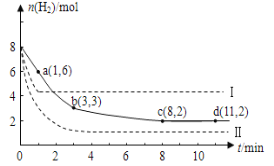
用纯净的CaCO3与l00mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积己折算为标准状况下的体积)。下列分析正确的是

A. EF段,用盐酸表示该反应的平均反应速率为0.4 mol·(L·min) -1
B. OE段表示的平均速率最快
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D. F点收集到的CO2的量最多
难度: 简单查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=c(CO).c(H2O)/[c(CO2).c(H2)]。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为正值
B. 恒温下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式为CO+H2O
CO2+H2
难度: 困难查看答案及解析
-
下列各表述正确的是
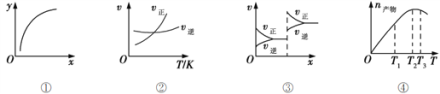
A. 图①表示在恒容容器中MgSO4(s) + CO(g)
MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
B. 图②表示其他条件一定时,反应A(g)+3B(g)
2C(g)的反应速率随温度变化的图像,正反应ΔH>0
C. 图③对应的反应一定是非等体积反应加压后平衡移动的变化情况
D. 恒压密闭容器中加入一定量A、B,发生反应A(g)+3B(g)
2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
难度: 困难查看答案及解析
-
下列事实不能说明亚硝酸是弱电解质的是
A. NaNO2溶液的pH大于7
B. 用HNO2溶液作导电试验,灯泡很暗
C. 常温下pH=4的HNO2稀释10倍pH<5
D. 常温下0.1mol/LHNO2溶液的pH为2.1
难度: 中等查看答案及解析
-
下列事实不能用平衡移动原理解释的是
A.
B.

C.
D.

难度: 中等查看答案及解析
-
在0.1 mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+。对于该平衡,下列叙述正确的是
A. 加入少量NaOH固体,平衡向正反应方向移动
B. 加水,平衡向逆反应方向移动
C. 滴加少量0.1mol/LHCl溶液,溶液中c(H+)减少
D. 加入少量CH3COONa固体,平衡向正反应方向移动
难度: 中等查看答案及解析
-
中和热的测定实验中,下列情况会导致测出来的中和热的数值偏小的是
①大小烧杯口未相平
②大烧杯上未盖硬纸板
③用环形铜丝搅拌棒搅拌反应混合溶液
④分多次将NaOH溶液倒入装盐酸的小烧杯中
⑤NaOH溶液稍过量
A. ①② B. ①②③ C. ①②③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
某二元酸(H2A)在水中的电离方程式为:H2A===H++HA-,HA-
H++A2-(25 ℃时Ka=1.0×10-2),下列有关说法中正确的是
A. H2A是弱酸
B. 稀释0.1 mol·L-1H2A溶液,因电离平衡向右移动而导致c(H+)增大
C. 在0.1 mol·L-1的H2A溶液中,c(H+)=0.12 mol·L-1
D. 若0.1 mol·L-1 NaHA溶液中c(H+)=0.02 mol·L-1,则0.1 mol·L-1H2A中c(H+)< 0.12 mol·L-1
难度: 简单查看答案及解析
-
在一密闭容器中,反应aA(g)
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增加了 D. 化学计量数关系:a>b
难度: 中等查看答案及解析
-
100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是( )
①N2O4的消耗速率与NO2的生成速率之比为1:2 ②NO2生成速率与NO2消耗速率相等③烧瓶内气体的压强不再变化④烧瓶内气体的质量不再变化 ⑤NO2的物质的量浓度不再改变⑥烧瓶内气体的颜色不再加深⑦烧瓶内气体的平均相对分子质量不再变化⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧ C. 只有①④ D. 只有⑦⑧
难度: 简单查看答案及解析
-
已知:CO(g)+H2O(g)
CO2(g)+H2(g) △H=-41kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号
起始时各物质的物质的量/mol
达平衡过程体系的能量变化
CO
H2O
CO2
H2
①
1
4
0
0
放出热量:32.8kJ
②
0
0
1
4
热量变化:Q
下列说法中,不正确的是
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 容器①中CO反应速率等于H2O的反应速率
D. 平衡时,两容器中CO2的浓度相等
难度: 中等查看答案及解析
-
在一定条件下,向2 L密闭容器中加入2 mol X、1 mol Y。发生如下反应:2X(g)+Y(?)
3Z(g) ∆H<0。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法正确的是
A. 反应开始至平衡时,用X表示的化学反应速率为1.2 mol/(L·min)
B. 该反应平衡常数表达式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新达平衡时X的体积分数一定增大
D. 若使容器体积变为1 L,Z的物质的量浓度一定增大
难度: 中等查看答案及解析