-
下列实验现象与对应结论均正确的是
选项
操作
现象
结论
A
向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液
溶液变为黄色
氧化性:H2O2>Fe3+
B
向硅酸钠溶液中滴加盐酸
溶液变浑浊
氯的非金属性强于硅,故而盐酸能制得硅酸。
C
向溴水中滴加苯
液体出现分层,上层有颜色下层接近无色
溴在苯中的溶解度远大于水中
D
将过量过氧化钠固体投入紫色石蕊试液中
溶液变成蓝色
过氧化钠与水反应生成氢氧化钠,溶液呈碱性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学创造了生活,也在改变着我们的生活,下列与化学有关的说法正确的是
A. 纯碱和生石灰均属于碱
B. 在海轮外壳上镶嵌锌块,会减缓船体的锈蚀
C. 经过必要的化学变化能从海水中提取NaCl、Mg、Br2等物质
D. 植物通过光合作用能将CO2转化为葡萄糖和O2,该反应为置换反应
难度: 简单查看答案及解析
-
只用下列一种试剂,就能将Ba(NO3)2、NaAlO2、NaHCO3、AlCl3四种无色透明溶液区别开来,这种试剂是 ( )
A. 硫酸 B. 盐酸 C. 氨水 D. 氢氧化钠溶液
难度: 中等查看答案及解析
-
将下列物质按酸、碱、盐分类顺序排列正确的是
A. 氢氟酸、烧碱、绿矾 B. 磷酸、纯碱、芒硝
C. 石炭酸、苛性钠、醋酸钠 D. 硫酸氢钠、碱石灰、皓矾
难度: 中等查看答案及解析
-
下列各项内容中,排列顺序正确的是
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3②物质的熔点Li>Na>K
③微粒半径:K+>S2->F-④单质的密度Na<K<Rb ⑤氢化物的沸点:H2Se>H2S>H2O
A. ①③ B. ②④ C. ①② D. ③⑤
难度: 中等查看答案及解析
-
下列说法正确的是
①NaCl 晶体中每个Na+同时吸引着6个Cl-,CsCl晶体中每个Cl-同时吸引着6个Cs+
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③因为氧化性:HClO>H2SO4,所以非金属性:Cl>S
④胶体的本质特征是丁达尔现象
⑤除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
⑥可用Ba(OH)2溶液同时鉴别能力Fe(NO3)3、AlCl3、NH4Cl、FeCl2、Na2SO4五种溶液
A. ②⑤⑥ B. ①②④ C. ②④⑤ D. ③⑤⑥
难度: 中等查看答案及解析
-
下列做法不正确的是
A. 易燃试剂与强氧化性试剂分开放置并远离火源
B. 在50 mL量筒中配制0.1000 mol·L-1碳酸钠溶液
C. 用湿润的红色石蕊试纸检验氨气
D. 金属钠着火时,用细沙覆盖灭火
难度: 中等查看答案及解析
-
下列说法正确的是
A. 含有共价键的物质中一定不含有金属元素
B. 非金属元素的氧化物不可能为碱性氧化物,金属元素的氧化物也不可能为酸性氧化物
C. 氢氧化铁溶胶、甘油与乙醇的混合液、蛋白质水溶液均具有丁达尔效应
D. 用新型生物降解塑料聚乳酸代替聚乙烯作食品包装袋,以防止白色污染,减缓能源危机
难度: 中等查看答案及解析
-
下列有关实验现象的描述不正确的是
A. 将表面变暗的金属钠粒投入干燥氯气中,无明显现象
B. 将在空气中点燃的金属钠伸入干燥氯气中会继续燃烧,产生黄色火焰和大量黄烟
C. 将SO2气体通入溴水中使溴水褪色,滴加BaCl2溶液有白色沉淀产生
D. SO2气体通入品红溶液中,品红褪色,加热所得无色溶液红色复原
难度: 中等查看答案及解析
-
下列关于有机化合物的说法不正确的是
A. 2,2-二甲基丙烷也称新戊烷
B. 苯和氯乙烯都能发生加成反应
C. C4H10O属于醇的同分异构体有4种
D. 橡胶和玻璃均属于人工合成的高分子化合物
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X的单质是空气中含量最高的气体,Y在四种元素中原子半径最大,Z的氧化物是光导纤维的主要成分,W与X是同主族元素。下列叙述正确的是
A. 离子半径X<Y B. 最高价氧化物的水化物的酸性Z<W
C. 氢化物沸点X<W D. Y3X和Z3X4中化学键类型相同
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列判断正确的是
A. 常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA
B. 标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L
C. 常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为0.3NA
D. 100g46%乙醇溶液中所含O-H数目为7NA
难度: 中等查看答案及解析
-
自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(
),杏仁含苯甲醛(
)。下列说法错误的是
A. 肉桂醛能发生加成反应、取代反应和加聚反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
难度: 中等查看答案及解析
-
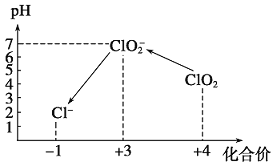
K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
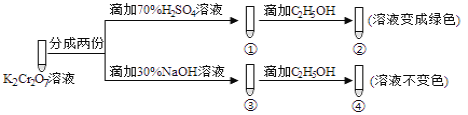
A. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
B. ②中C2H5OH被Cr2O72-氧化成CH3COOH
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. ①中溶液橙色加深,③中溶液变黄
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式为
A. NH4HCO3溶于过量的浓KOH溶液中:NH4++ HCO3-+2OH-= CO32-+ NH3·H2O+2 H2O
B. 醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
C. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+===SO2↑+H2O
D. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:Al3++2SO42-+2Ba2++4OH -= AlO2-+2BaSO4↓+2H2O
难度: 中等查看答案及解析
-
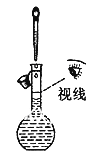
下列操作或装置能达到实验目的的是
A. 配制一定浓度的氯化钠溶液
 B. 除去氯气中的氯化氢
B. 除去氯气中的氯化氢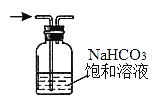 C. 观察铁的吸氧腐蚀
C. 观察铁的吸氧腐蚀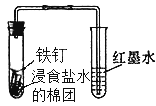 D. 检查乙炔的还原性
D. 检查乙炔的还原性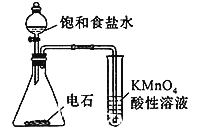
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色溶液中: Ca2+、Cu2+、Br-、Cl- 、
B. c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、Cl-、I-
C. 能使酚酞变红的溶液中: K+、Na+、SiO32-、SO42-
D.
=0.1mol·L-1的溶液中: NH4+、Mg2+、SO42-、CH3COO-
难度: 中等查看答案及解析
-
向200 mL 2 mol·L -1 HNO 3溶液中,逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe 2+)随n(Fe)变化如图所示。下列有关说法正确的是
A. 该过程中产生标准状况下的氢气4.48 L
B. 向c点处的反应液中加入稀盐酸后无明显现象
C. 图中a=1、b =1.5
D. 当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol
难度: 中等查看答案及解析