-
化学与人类的生活、生产息息相关,下列说法不正确的是
A. “地沟油”禁止食用,但可以用来制肥皂或燃油
B. 水泥、陶瓷、玻璃工业的生产原料中都用到了石灰石
C. 光导纤维的主要成分是SiO2,太阳能电池使用的材料是单质硅
D. 双氧水、高锰酸钾溶液可杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同
难度: 简单查看答案及解析
-
氢化钙固体是登山运动员常用的能源供给剂,在实验室中可以用金属钙与氢气加热反应制取。下列说法正确的是
A. 氢化钙中的氢元素为+1价
B. 氢化钙可用作还原剂和制氢材料
C. 氢化钙(CaH2)是离子化合物,固体中含有H—H键
D. 可以取少量试样滴加几滴水,检验反应是否产生氢气来区别金属钙与氢化钙
难度: 中等查看答案及解析
-
某化合物水溶液中加入过量Na2O2,最终有白色沉淀产生。下列化合物中符合条件的是
A. A1C13 B. NaHCO3 C. FeC12 D. Ca(HCO3)2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 400mL 1mol·L-1稀硝酸与Fe完全反应(还原产物只有NO),转移电子的数目为0.3NA
B. 1mol·L-1的A1C13溶液中含有C1-的个数为3NA
C. 0.2mol H2O和D2O中含有中子的数目为2NA
D. 标准状况下,2.24LC12溶于水所得氯水中含氯的微粒总数为0.2NA
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明的溶液中:K+、Cu2+、NO3-、C1-
B. 在中性溶液中:Mg2+、Fe3+、Na+、SO42-
C. pH=12的溶液:Na+、K+、SiO32-、C1-
D. 使甲基橙变红的溶液中:Na+、Fe2+、NO3-、C1-
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,W与Y同族,Z的原子半径是其所在周期主族元素原子中最小的,且Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 最高价氧化物的水化物的酸性:Y>Z B. 气态氢化物的热稳定性:W<Y
C. Y与Z形成的化合物为共价化合物 D. 简单离子半径:W<X<Z
难度: 中等查看答案及解析
-
元素在周期表中的位置反映了元素的原子结构和元素的性质。下列说法正确的是
A. 在过渡元素中寻找优良催化剂及耐高温和耐腐蚀的材料
B. 同一元素不可能既表现金属性又表现非金属性
C. 元素的最高正化合价等于它所处的主族序数
D. 短周期元素形成离子后最外层都达到8电子稳定结构
难度: 简单查看答案及解析
-
对于下图所示实验,下列实验现象预测或操作正确的是
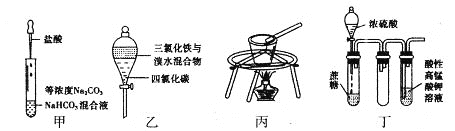
A. 实验甲:匀速逐滴滴加盐酸时,试管中没气泡产生和有气泡产生的时间段相同
B. 实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色
C. 实验丙:用瓷坩埚融化NaOH
D. 装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 向Fe(OH)3中加氢碘酸:Fe(OH)3+3H+=Fe3++3H+
B. 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32-
C. 过量SO2通入到NaC1O溶液中:SO2+H2O +C1O-==HC1O+HSO3-
D. 等体积等物质的量浓度的:NaHCO3和Ba(OH)2两溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 中等查看答案及解析
-
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I−的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是
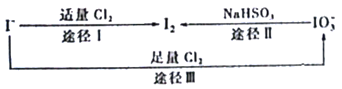
A. 向含I−的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3−
D. 一定条件下,I−与IO3−可能生成I2
难度: 中等查看答案及解析
-
下列实验操作能达到相应实验目的的是
选项
实验操作
实验目的
A
取少量试液于试管中,加入盐酸酸化的氯化钡溶液,差生白色沉淀
检验溶液中含有SO42-
B
取少量溶液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸靠近试管口,观察试纸颜色变化
检验溶液中是否含有NH4+
C
将饱和氯化铁溶液滴入氢氧化钠稀溶液中并加热
制备氢氧化铁胶体
D
称取0.40g NaOH固体,置于100mL容量瓶中加水至刻度线
配制0.10mol/L NaOH溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
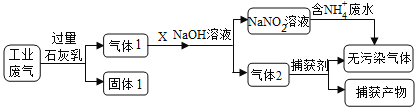
某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2===Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是
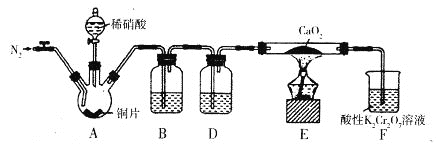
A. 通入N2是为了排尽装置中的空气
B. 装置B、D中的试剂可分别为水和浓硫酸
C. 将铜片换成木炭也可以制备纯净的亚硝酸钙
D. 借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
难度: 困难查看答案及解析
-
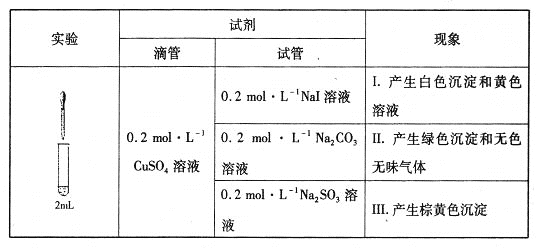
下列叙述正确的是
A. 向CaCO3固体中滴加稀盐酸,将产生的气体通入Na2SiO3溶液中,产生白色胶状物质,可证明酸性:HC1>H2CO3>H2SiO3
B. 向铁的氧化物中加入盐酸至恰好溶解,再滴入少量酸性KMnO4溶液,KMnO4溶液紫色褪去,则溶液中含有Fe2+
C. 将少量的溴水分别滴入FeC12溶液、NaI溶液中,再分别滴加CC14振荡,下层分别呈无色和紫红色,则说明还原性:I->Fe2+>Br-
D. 向NH4A1(SO4)2溶液中逐滴加入NaOH溶液,先产生白色沉淀,接着产生刺激性气味的气体,最后沉淀逐渐溶解
难度: 中等查看答案及解析
-
某离子反应涉及H2O、C1O-、NH4+、H+、N2、C1-六种微粒,其中c(NH4+)随着反应的进行逐渐减小,下列判断错误的是
A. 氧化产物是N2
B. 消耗1mol氧化剂,转移电子2mol
C. 反应后溶液的酸性明显减弱
D. 氧化剂与还原剂的物质的量之比为3:2
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型、高效的水处理剂,工业上通常用下列反应先制得高铁酸钠:2FeC13+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,然后在某低温下,在高铁酸钠溶液中加KOH固体至饱和就可析出高铁酸钾。下列说法不正确的是
A. NaC1O在反应中作氧化剂
B. 制取高铁酸钠时,每生成1mol Na2FeO4,反应中共有6mol电子转移
C. 高铁酸钾在低温下的溶解度比高铁酸钠的溶解度小
D. K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮杂质
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液中c(SO42-)+c(NO3-)=3.0mol·L-1,取200mL该混合酸,则能溶解铜的最大物质的量为
A. 0.36mol B. 0.24mol C. 0.30 mol D. 0.20mol
难度: 中等查看答案及解析