-
在KClO3+6HCl===KCl+3Cl2↑+3H2O中,被氧化与被还原的氯原子个数比为 ( )
A. 1﹕6 B. 6﹕1 C. 1﹕5 D. 5﹕1
难度: 简单查看答案及解析
-
能正确表示下列化学反应的离子方程式的是
A. 氢氧化钡溶液与硫酸的反应:OH-+H+===H2O
B. 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
C. 铜片插入硝酸银溶液中:Cu+Ag+===Cu2++Ag
D. 碳酸钙溶于稀盐酸中:CaCO3+2H+="==" Ca2++H2O+CO2↑
难度: 中等查看答案及解析
-
根据反应式:(1)2Fe3++2I-===2Fe2++I2,(2)Br2+2Fe2+===2Fe3++2Br-,
可判断离子的还原性从强到弱的顺序是( )
A. Br-、Fe2+、I- B. I-、Fe2+、Br-
C. Br-、I-、Fe2+ D. Fe2+、I-、Br-
难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
A. 强碱性溶液中:K+、Al3+、Cl-、SO42—
B. 在无色透明的溶液中:K+、Cu2+、NO3—、SO42—
C. 含有0.1 mol·L−1 Ca2+的溶液中:Na+、K+、CO32—、Cl-
D. 室温下,pH=1的溶液中:Na+、Fe3+、NO3—、SO42—
难度: 简单查看答案及解析
-
下列属于非电解质的是
A. 葡萄糖 B. 氢氧化钠 C. 氯化钾 D. 铁
难度: 简单查看答案及解析
-
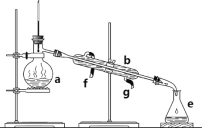
下列化学实验基本操作中正确的是
A. 分液时,碘的四氯化碳溶液从分液漏斗下口放出,水层从上口倒出
B. 蒸馏时,水从冷凝管上部通入,从下部流出
C. 蒸发结晶时应将溶液蒸干
D. 称量时,将纯碱放在称量纸上置于托盘天平的右盘,将砝码放在托盘天平的左盘
难度: 简单查看答案及解析
-
下列对于“摩尔”的理解正确的是( )
A. 摩尔是国际科学界建议采用的一种物理量
B. 22.4LO2 中所含氧气分子数为 1NA 个
C. 1mol 氧含 6.02×1023 个 O2
D. 摩尔是物质的量的单位,简称摩,符号为 mol
难度: 简单查看答案及解析
-
下列关于胶体的叙述不正确的是
A. 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9~10-7m之间
B. 胶体和溶液一样,其分散质可透过滤纸
C. 用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D. Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
难度: 中等查看答案及解析
-
下列溶液中Cl-的物质的量浓度最大的是
A. 200mL 0.2mol/L MgCl2溶液
B. 500mL 0.5mol/L NaCl溶液和500mL0.5mol/L KCl的混合液
C. 250mL 0.2mol/L AlCl3溶液
D. 300mL 1.0mol/L KClO3溶液
难度: 中等查看答案及解析
-
某同学在实验报告中记录下列数据,其中正确的是( )
A. 用25 mL量筒量取12.36 mL盐酸
B. 用托盘天平称量8.75 g食盐
C. 配制450 mL溶液选用500mL的容量瓶
D. 用广泛pH试纸测得某溶液的pH为3.5
难度: 简单查看答案及解析
-
下列关于摩尔质量的说法正确的是
A. 水的摩尔质量是18g
B. 2mol水的摩尔质量是1mol水摩尔质量的2倍
C. 任何物质的摩尔质量都等于它的相对分子质量或相对原子质量
D. 水的摩尔质量是氢气摩尔质量的9倍
难度: 简单查看答案及解析
-
学习完“从实验学化学”这一章以后,对下列说法你认为正确的是
A. 用两只250 mL的容量瓶配制0.1mol/L 500 mL的NaOH溶液
B. 加热试管内物质时,试管底部与酒精灯灯芯接触
C. 易燃试剂与强氧化性试剂分开放置并远离火源
D. 提取溴水中的溴,可用加入乙醇萃取的方法
难度: 简单查看答案及解析
-
下列化学方程式中,不能用离子方程式:H++OH-=H2O表示的是
A. 2NaOH+H2SO4=Na2SO4+2H2O
B. Ba(OH)2 +2HCl=BaCl2+2H2O
C. KOH+HCl=KCl+H2O
D. Cu(OH)2+2HNO3= Cu(NO3)2+2H2O
难度: 中等查看答案及解析
-
仪器名称为“量筒”的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列属于酸性氧化物的是
A. H2CO3
B. CO
C. SO2
D. CaO
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 常温常压下,48g O2和O3的混合气体中含有氧原子数为3NA
B. 17 g氨气所含质子数目为11NA
C. 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA
D. 物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为1 NA
难度: 中等查看答案及解析
-
某溶液中只含有Na+、Al3+、Cl−、SO42−四种离子,已知前三种离子的个数比为5∶2∶1,则溶液中Al3+和SO42−的离子个数比为
A. 1∶2 B. 1∶4 C. 3∶4 D. 2∶5
难度: 简单查看答案及解析
-
一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为
A. 3.0 mol B. 1.5 mol C. 1.0 mol D. 0.75 mol
难度: 中等查看答案及解析
-
硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为S2O
+4Cl2+5H2O===2SO
+10H++8Cl-,该反应中( )
A. H2O被氧化 B. Cl2作还原剂
C. S元素化合价降低 D. Cl2表现氧化性
难度: 简单查看答案及解析
-
铝与稀硝酸发生反应的化学方程式为;Al+HNO3=Al(NO3)3+NO↑+H2O,若配平方程式后,HNO3的计量系数应该是( )
A. 2 B. 4 C. 6 D. 8
难度: 简单查看答案及解析
-
下列反应中,既属于氧化还原反应又属于置换反应的是( )。
A. CuO+H2
Cu+H2O
B. CO2+Ca(OH)2=CaCO3↓+H2O
C. Fe2O3+3CO
2Fe+3CO2
D. 2Na+Cl2
2NaCl
难度: 中等查看答案及解析
-
古装电视剧中经常有“银针验毒”的剧情,医学上对“银针验毒”的解释是:
4Ag + 2H2S + O2 = 2Ag2S + 2H2O,其中H2S
A. 是氧化剂 B. 是还原剂
C. 既是氧化剂又是还原剂 D. 既不是氧化剂也不是还原剂
难度: 中等查看答案及解析
-
在反应8NH3+3Cl2=N2+6NH4Cl中,被还原物质与被氧化物质分子数之比
A. 8∶3 B. 3∶8
C. 3∶2 D. 1∶3
难度: 中等查看答案及解析
-
下列粒子中,既有氧化性又有还原性的是
A. Na+
B. F2
C. Fe2+
D. Cl-
难度: 简单查看答案及解析