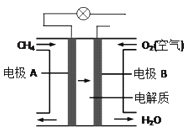
-
下列物质溶于水后溶液显酸性的是
A. KHCO3 B. NH2CH2COONa C. NH4NO3 D. CH3OH
难度: 简单查看答案及解析
-
优质空气利于身心健康。均会造成空气污染的一组物质是( )
A. CO2和NO2 B. SO2和NO2 C. H2O和SO2 D. H2O和CO2
难度: 简单查看答案及解析
-
对已经达到化学平衡的2X(g)+Y(g)
2Z(g)减小压强时,对反应的影响是( )
A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C. 正、逆反应速率都减小,平衡向逆反应方向移动
D. 正、逆反应速率都增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
0.1mol/LCH3COOH溶液加水稀释或升高温度的过程中,下列表达式的数值一定变大的是
A. c(H+) B. c(H+)·c(OH-) C.
D.
难度: 中等查看答案及解析
-
有①Na2SO3溶液②CH3COOH溶液③HCl溶液各25mL,物质的量浓度均为0.1mol/L.下列说法正确的是( )
A. 三种溶液的pH的大小顺序是①>②>③
B. 三种溶液稀释相同倍数,pH变化最大的是①
C. 三种溶液中含微粒种类多少顺序是:②>①>③
D. 三种溶液中由水电离出c(H+)大小顺序是:③>②>①
难度: 中等查看答案及解析
-
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
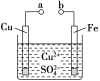
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b用导线连接时,铁片作正极
难度: 中等查看答案及解析
-
依据下表25℃时某些弱酸的电离平衡常数,判断下列说法正确的是
CH3COOH
HC1O
H2CO3
Ka=1.8×l0-5
Ka=3.0×l0-8
Ka1=4.4×l0-7 Ka2=4.7×l0-11
A. 向NaClO溶液中通入少量CO2的离子方程式为:2C1O-+CO2+H2O==2HC1O+CO32-
B. 相同浓度的CH3COOH和NaClO的溶液中,水的电离程度前者大
C. 向0. lmol • L-l的CH3COOH溶液中滴加NaOH溶液至pH = 5,此时溶液的 c(CH3COOH):c(CH3COO-) =5∶9
D. 常温下,0• lmol • L-1 的 NaHC2O4 溶液 pH =4: c(HC2O4-) >c(H+)>c(H2C2O4)>c(C2O42-)
难度: 困难查看答案及解析