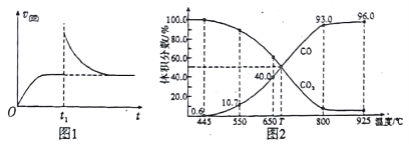
-
在日常生活中,下列解决问题的方法不可行的是
A. 为加快漂白粉的漂白速率,使用时可滴加儿滴醋酸
B. 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中
C. 为增强治疗缺铁性贫血效果,可在口服硫酸亚铁片时同服维生素C
D. 为使水果保鲜。可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土
难度: 中等查看答案及解析
-
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为
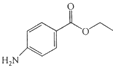 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是A. 分子式为C9H14NO2
B. 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种
C. 1mol该化合物最多与4mol氢气发生加成反应
D. 分子中将氨基转化成硝基的反应为氧化反应
难度: 中等查看答案及解析
-
某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质。为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法正确的是( )
A. 起始滤液常温下pH=7 B. 试剂Ⅰ为 Ba(NO3)2溶液
C. 上图过程须经2次过滤 D. 步骤③的目的是除去 CO32-
难度: 简单查看答案及解析
-
利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
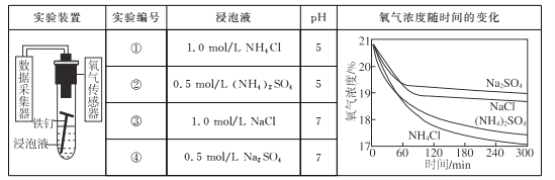
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl-是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 常见气态氢化物的稳定性:X<Y<Z
C. 1 mol WM溶于足量水中完全反应,共转移2 mol电子
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
难度: 中等查看答案及解析
-
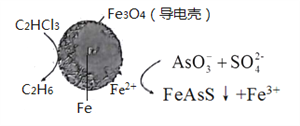
亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液pH关系如下图所示。下列说法中,不正确的是

A. K3AsO3溶液中的水解方程式:AsO33-+H2O
HAsO32-+OH-
B. pH=12.8时,c(HAsO32-) >c(H2AsO3-)=c(AsO33-)
C. pH = 12时,溶液中c(H2AsO3-) + 2c(HAsO32-) + 3c(AsO33-) + c(OH-) = c(H+)
D. pH=9.2时,在H2AsO3-和H3AsO3的混合溶液中:c(H2AsO3-):c(H3AsO3)=1:1
难度: 中等查看答案及解析




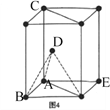
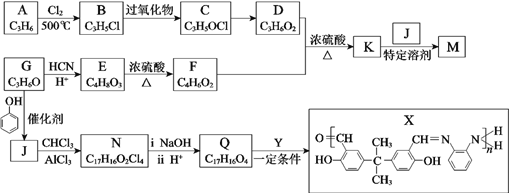
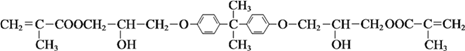 是牙科粘合剂, X是高分子金属离子螯合剂,以下是两种物质的合成路线:
是牙科粘合剂, X是高分子金属离子螯合剂,以下是两种物质的合成路线: