-
2017年4月22日是第48个世界地球日,我国确定的活动主题为“节约集约利用资源,倡导绿色简约生活——讲好我们的地球故事”。下列行为不符合这一活动主题的是()
A. 加大清洁能源的开发利用,提高资源的利用率
B. 用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用
C. 加大铅蓄电池、含汞锌锰干电池的生产,满足消费需求
D. 对工业废水、生活污水进行净化处理,减少污染物的排放
难度: 简单查看答案及解析
-
下列有关化学用语的表示正确的是
A. 中子数为20的氯原子:
B. 次氯酸的电子式:
C. 氮原子的结构示意图:
D. 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32-
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是 ( )
A. 一定条件下,0.2 mol SO2与足量O2充分反应,生成SO3分子数为0.2NA
B. 0.1 mol —NH2(氨基)中含有的电子数为0.7NA
C. 3.4 g H2O2中含有的共用电子对数为0.1NA
D. 常温常压下,16 g O2和O3混合气体含有的氧原子数为NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 将少量SO2气体通入过量氨水中:SO2+NH3·H2O=NH4++HSO3-
B. 铝溶于NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH-
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是()
A. 能使甲基橙变红的溶液:Na+、NH4+、NO3-、CO32-
B. 加入苯酚显紫色的溶液:K+、NH4+、Cl-、SCN-
C. 常温下,c(H+)/c(OH—)=1×10-14的溶液:K+、Na+、AlO2-、HCO3-
D. 澄清透明的溶液:Cu2+、NH4+、NO3-、SO42-
难度: 中等查看答案及解析
-
用下列实验装置和方法进行相应实验,能达到实验目的的是()
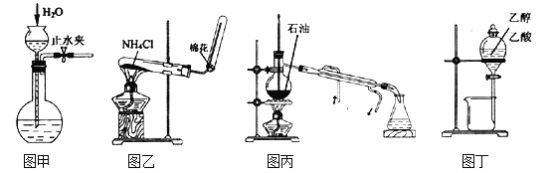
A. 用图甲所示方法检查装置的气密性
B. 用图乙所示装置制取氨气
C. 用图丙所示装置分馏石油获得汽油
D. 用图丁所示装置分离乙醇与乙酸
难度: 中等查看答案及解析
-
氯酸是强酸,在酸性介质中是强氧化剂,可与碘单质发生反应2HC103+I2—2HI03+C12↑①,若碘单质过量,还会发生反应C12+I2=2IC1②。下列有关说法正确的是( )
A. HIO3是I元素的最高价氧化物对应的水化物
B. 化学方程式①表明I2的氧化性强于Cl2
C. 反应①中,每形成0.1mol非极性键,转移1 mol电子
D. IC1在烧碱溶液中发生水解,生成物为Nal和NaCIO
难度: 中等查看答案及解析
-
下列物质转化在给定条件下不能实现的是( )
A. Fe2O3
FeCl3(aq)
无水FeCl3
B. Al2O3
NaAlO2(aq)
AlCl3(aq)
C. NH3
NO
HNO3
D. SiO2
H2SiO3
Na2SiO3
难度: 中等查看答案及解析
-
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
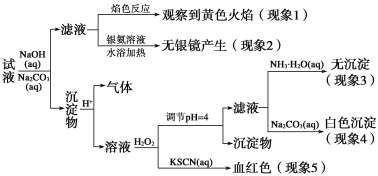
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )。
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X、W同主族,Z+与Y3-具有相同的电子层结构,W的氧化物是生产光纤制品的基本原料。下列说法正确的是( )
A. 粒子半径:r(W)>r(X)>r(Z+)>r(Y3-)
B. X的最高价氧化物对应水化物的酸性比Y的强
C. W的简单气态氢化物的热稳定性比X的强
D. ZY3晶体中含有离子键和共价键
难度: 中等查看答案及解析
-
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应极小,因而被广泛适用于敏感细菌所致的尿路感染、皮肤软组织感染以及急性扁桃体炎、急性咽炎、中耳炎和肺部感染等的治疗。已知肽键可以在碱性条件下水解。下列对头孢羟氨苄的说法中正确的是( )
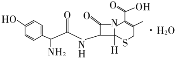
A. 头孢羟氨苄的化学式为C16H16N3O5S·H2O
B. 1 mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4 mol和Br2 3mol
C. 在催化剂存在的条件下,1mol头孢羟氨苄消耗7 mol H2
D. 头孢羟氨苄能在空气中稳定存在
难度: 简单查看答案及解析
-
下列物质在给定条件下的同分异构体数目正确的是( )
A. C4H10属于烷烃的同分异构体有3种
B. 分子组成是C5H10O2属于羧酸的同分异构体有5种
C. 分子组成是C4H8O属于醛的同分异构体有3种
D. 结构简式为
的一溴代物有5种
难度: 困难查看答案及解析
-
除去下列物质中所含的少量杂质的方法正确的是( )
选项
物质
杂质
试剂
提纯方法
A
BaSO4
BaCO3
水
溶解、过滤、洗涤
B
CO2
SO2
饱和Na2CO3溶液
洗气
C
乙酸乙酯
乙酸
稀NaOH溶液
混合振荡、静置分液
D
蛋白质
葡萄糖
浓(NH4)2SO4溶液
盐析、过滤、洗涤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验过程中产生的现象与对应的图形相符合的是( )
A. NaHSO3粉末加入HNO3溶液中
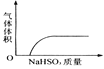 B. H2S气体通入氯水中
B. H2S气体通入氯水中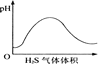
C. NaOH溶液滴入Ba(HCO3)2溶液中
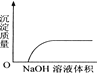 D. CO2通入澄清石灰水中
D. CO2通入澄清石灰水中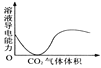
难度: 简单查看答案及解析
-
以苯为基本原料可制备X、Y、Z、W等物质,下列有关说法中正确的是( )
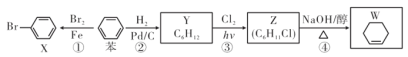
A. 反应①是苯与溴水的取代反应 B. 可用AgN03溶液检测W中是否混有Z
C. X、苯、Y分子中六个碳原子均共平面 D. 反应④中产物除W外还有H2O和NaCl
难度: 中等查看答案及解析
-
已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略)。A
B
C
D下列说法不正确的是( )
A. 若A为非金属单质,则它与Mg反应的产物中阴阳离子个数比可能为2∶3
B. 若A为非金属单质,则其组成元素在周期表中的位置可能处于第二周期第ⅣA族
C. 不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下都能使铁和铝发生钝化
D. 若A是共价化合物,0.1molA分子中含有的电子数可能为NA(NA为阿伏加德罗常数的值)
难度: 中等查看答案及解析
-
X、Y、Z、W 为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是
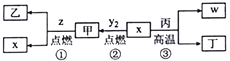
A. 反应①、②、③都属于氧化还原反应 B. X、Y、Z、W四种元素中,Y的原子半径最小
C. Na 着火时,可用甲扑灭 D. 一定条件下,x与甲反应生成丁
难度: 中等查看答案及解析
-
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol·L﹣1NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中不正确的是( )
A. 当金属全部溶解时,失去电子的物质的量为0.3mol
B. 标准状态下,当金厲全部溶解时收集NO气体体积为3.36L
C. 当生成的沉淀量达最大时,消耗NaOH溶液的体积V≥100mL
D. 参加反应的金属总质量为9.6g>m>3.6g
难度: 中等查看答案及解析
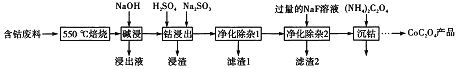
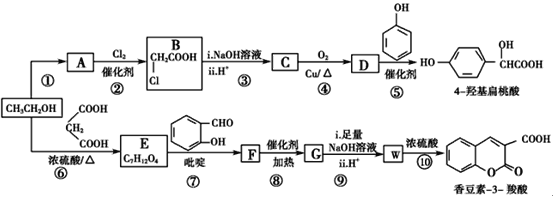
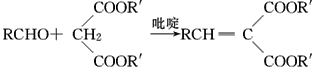 (R,R′,R″表示氢原子、烷基或芳基)
(R,R′,R″表示氢原子、烷基或芳基)