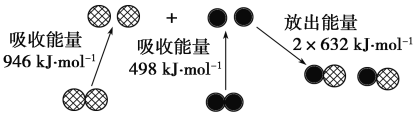
-
下列说法正确的是( )
A. 熵增大的反应一定可自发进行 B. 熵减小的反应一定可自发进行
C. ΔH<0的反应可能自发进行 D. ΔH>0的反应不可能自发进行
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是
A. 铝片与稀H2SO4反应 B. Ba(OH)2·8H2O与NH4Cl反应
C. 灼热的炭与CO2反应 D. 甲烷在O2中的燃烧反应
难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是
A. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B. 由C(金刚石)→C(石墨)ΔH=" -1.9KJ/mol" 可知,金刚石比石墨稳定
C. 在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol
D. 稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 具有较高能量的反应物分子称为活化分子 B. 升高温度增大了活化分子百分数
C. 催化剂能够改变化学反应途径 D. 增大压强能提高活化分子的浓度
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A. C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ/mol(中和热)
C. S(s)+O2(g)===2SO2(g) ΔH=-296.8 kJ/mol(反应热)
D. 2NO2===O2+2NO ΔH=+116.2 kJ/mol(反应热)
难度: 简单查看答案及解析
-
已知热化学方程式:
SO2(g)+1/2O2(g)
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
A. 196.64 kJ B. 196.64 kJ/mol C. <196.64 kJ D. >196.64 kJ
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①铁在潮湿的空气中容易生锈
②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深
③实验室可用排饱和食盐水的方法收集氯气
④钠与氯化钾共融制备钾 Na(l)+KCl(l)
K(g)+NaCl(l)
⑤开启啤酒瓶后,瓶中马上泛起大量泡沫
A. ③④ B. ①② C. ①⑤ D. ①②⑤
难度: 中等查看答案及解析
-
一定条件下反应2AB(g)
A2(g) +B2(g),不能确定达到平衡状态的是
A. 单位时间内生成n mol A2,同时生成2n molAB
B. 单位时间内生成n mol B2,同时生成2n molAB
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的物质的量分数不随时间变化
难度: 中等查看答案及解析
-
以下各条件的改变可确认发生了化学平衡移动的是
A. 化学反应速率发生了改变
B. 有气态物质参加的可逆反应达到平衡后,改变了压强
C. 由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D. 可逆反应达到平衡后,加入了催化剂
难度: 中等查看答案及解析
-
对于工业上合成氨的反应N2+3H2
2H3列有关说法错误的是
A. 达到平衡时,反应停止了 B. 达到平衡时,正、逆反应速率相等
C. 增大N2浓度,可加快反应速率 D. 使用合适的催化剂,可加快反应速率
难度: 简单查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)
Z(g)+W(s) ΔH>0,下列叙述正确的是( )
A. 加入少量W,逆反应速率增大
B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动
D. 平衡后加入X,上述反应的ΔH增大
难度: 简单查看答案及解析
-
在2A+B
3C+4D中,表示该反应速率最快的是( )
A. υ(A) = 0.5mol·L-1·S-1 B. υ(B) =" 0.3" mol·L-1·S-1
C. υ(C) = 0.8mol·L-1·S-1 D. υ(D)=" 1" mol·L-1·S-1
难度: 中等查看答案及解析
-
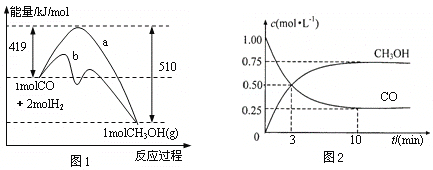
符合图1、图2的反应是
A. X+3Y
2Z ΔH>0 B. X+3Y
2Z ΔH<0
C. X+2Y
3Z ΔH<0 D. 5X+3Y
4Z ΔH<0
难度: 中等查看答案及解析
-
下列关于化学反应限度的说法中正确的是( )
A. 改变外界条件不能改变化学反应限度
B. 当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C. 当某反应体系中气体的压强不再改变时,该反应一定达到了反应限度
D. 当某反应达到反应限度时,反应物和生成物的浓度一定相等
难度: 简单查看答案及解析
-
在某温度下,可逆反应mA(g)+nB(g)
pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )
A. K越大,达到平衡时,反应进行的程度越大
B. K越小,达到平衡时,反应物的转化率越大
C. K随反应物浓度的改变而改变
D. K随温度和压强的改变而改变
难度: 困难查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是
A. c1 : c2=1 : 3 B. 平衡时,3υY (正) =2υZ (逆)
C. X、Y的转化率不相等 D. c1的取值范围为0.06<c1<0.16 mol/L
难度: 中等查看答案及解析
-
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g) + Y(g)
M(g) + N(g),所得实验数据如下表:
实验
编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法正确的是
A. 实验①中,若5 min时测得n (M) == 0.050 mol,则0至5 min时间内,用N表示的平均反应速率υ (N) = 1.0×10-2 mol/(L·min)
B. 实验②中,该反应的平衡常数K = 2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
难度: 中等查看答案及解析
-
COCl2(g)
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,其中能提高COCl2转化率的是
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
难度: 中等查看答案及解析
-
在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)
2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是
A. 0.16 B. 0.08 C. 0.04 D. 0.02
难度: 中等查看答案及解析
-
图为某化学反应速率一时间图。在t1时刻升高温度或增大压强,都符合图所示变化的反应是
A. 4NH3(g)+5O2(g)
4NO(g)+6H2O(g)ΔH<0
B. 2SO2(g)+O2(g)
2SO3(g)ΔH< 0
C. H2(g)+I2(g)
2HI(g)ΔH>0
D. C(s)+H2O(g)
CO(g)+H2(g)ΔH>0
难度: 简单查看答案及解析