-
运用所学知识回答下列问题:
(1)常温下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:___。
(2)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s) ΔH=-989.2kJ·mol-1,有关键能数据如下表:
| 化学键 | Si—O | O=O | Si—Si |
| 键能/kJ·mol-1 | x | 498.8 | 176 |
已知1molSi中含2molSi—Si键,1molSiO2中含4molSi—O键,则x的值为__。
(3)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,目的是___。
(4)在稀释醋酸的过程中,下列始终保持增大趋势的量是(______)
A.c(H+) B.H+个数 C.CH3COOH分子数 D.
(5)某温度(t℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),若所得混合溶液的pH=2,则a∶b=__。
(6)已知Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应至少调至__。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应至少调至__。
-
(9分)化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5 g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(2)已知化学键的键能为:
| 化学键 | H—H | N—H | 
|
| 键能/( kJ·mol-1) | 436 | 391 | 945 |
又知反应N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1。试根据表中所列键能数据估算a的值为 。
2NH3(g) ΔH=a kJ·mol-1。试根据表中所列键能数据估算a的值为 。
(3)已知:C(石墨,s)+O2(g) CO2(g) ΔH=-393 kJ·mol-1
CO2(g) ΔH=-393 kJ·mol-1
2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l) ΔH=-2599 kJ·mol-1
4CO2(g)+2H2O(l) ΔH=-2599 kJ·mol-1
根据盖斯定律,计算298 K时C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的焓变为 。
-
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式___________________________
(2) 已知反应N2+3H2  2NH3 △H=a kJ·mol-1。试根据下表中所列键能数据估算a的数值为________________。
2NH3 △H=a kJ·mol-1。试根据下表中所列键能数据估算a的数值为________________。
| 化学键 | H—H | N—H | N≡N |
| 键能KJ/mol | 436 | 391 | 945 |
(3) 丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g) === 3CO2(g)+4H2O(l) ΔH=-akJ·mol-1
途径Ⅱ:C3H8(g) === C3H6(g)+H2(g) ΔH=+bkJ·mol-1
2C3H6(g)+9O2(g) === 6CO2(g)+6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g) === 2H2O(l) ΔH=-d kJ/mol-1(a、b、c、d均为正值)。请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
②在C3H8(g) === C3H6(g)+H2(g)的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物,因此其反应条件是__________。
③b与a、c、d的数学关系式是________________________。
-
(1)实验测得,5 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式:_________________________________________。
(2)下图为N2(g)和O2(g)生成NO (g)过程中的能量变化:
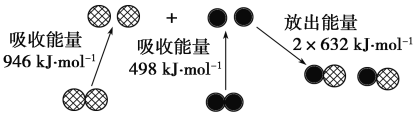
则N≡N键的键能为________kJ·mol-1。根据上图写出N2(g)和O2(g)生成NO(g)的热化学方程式:_____________________________________________________________
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知: C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1③
根据盖斯定律,计算298 K时由C(石墨,s)和H2(g)生成1 mol C2H2(g)反应的焓变:________________________________________________________________________。
(4)接触法制硫酸工艺中,其主反应在450 ℃并有催化剂存在下进行:2SO2(g)+O2(g)  2SO3(g) ΔH=-190 kJ·mol-1。
2SO3(g) ΔH=-190 kJ·mol-1。
①该热化学反应方程式的意义是___________________________________________________
②已知单质硫16 g燃烧放热为149 kJ,写出硫燃烧热的热化学方程式:_________________
-
(1)实验测得,5 g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,甲醇的燃烧热ΔH=______________________;
(2)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,已知室温下1g甲硅烷自燃放出热量44.6kJ,其热化学方程式________________。
(3)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。
已知:N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4 (g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式:______________。
-
(1)实验测得,4g甲醇液态在氧气中充分燃烧生成二氧化碳气体和液态水时释放出90kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(2) 已知反应N2(g)+3H2(g) 2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值:_________________。
2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值:_________________。

(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1 ①
2H2(g)+O2(g)== 2H2O(I) △H2=-571.6kJ·mol-1 ②
2C2H2(g)+5O2(g)== 4CO2(g)+2H2O(I) △H3 =-2599kJ·mol-1③
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:____________。
-
(6分)按要求回答下列问题:
(1)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
________
(2)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应生成正盐时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式
_____________________。
(3)已知下列反应的焓变:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) △H2=-393.5kJ/mol
③2 H2(g)+O2(g) =2H2O(l) △H3=-285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=________
-
(1)实验测得16 g甲醇CH3OH(l)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧的热化学方程式: ____________________。
(2)合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=a kJ·mol-1,反应过程的能量变化如图所示:
2NH3(g) ΔH=a kJ·mol-1,反应过程的能量变化如图所示:
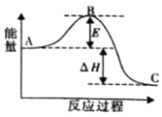
①该反应通常用铁作催化剂,加催化剂会使图中E______(填“变大”或“变小”),E的大小对该反应的反应热有无影响?______(填“有”或“无”)。
②有关键能数据如下:
| 化学键 | H—H | N—H | N≡N |
| 键能(kJ·mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a为____________。
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:①N2(g)+2O2(g)=2NO2(g) △Η1=a kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △Η2=bkJ/mol
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:_____________________。
-
(1)实验测得16g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧热的热化学方程式:_______________________.
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程.已知反应:N2(g)+3H2(g)⇌2NH3(g)△H=a kJ•mol﹣1.有关键能数据如表:
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ/mol) | 436 | 391 | 945 |
试根据表中所列键能数据估算a的数值_______________.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.已知:
C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJ•mol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJ•mol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2599kJ•mol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的反应热为:△H=____________________.
(4)在微生物作用下,NH4+经过两步反应被氧化成NO3﹣。两步反应的能量变化示意图如图:
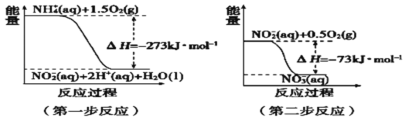
第一步反应是________反应(填“放热”或“吸热”),原因是_________________________
-
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式____________________________________。
(2)己知反应N2+3H2 2NH3 △H=akJ/mol。试根据下表中所列键能数据估算a的数值为______。
2NH3 △H=akJ/mol。试根据下表中所列键能数据估算a的数值为______。
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
己知:C(s,石墨)+O2(g)=CO2(g) △Hl=-393. 5kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
2C2H2(g) +5O2(g) =4CO2(g) +2H2O(1) △H3=-2599kJ/mol
裉推盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应热化学方程式:__________。

2SO3(g) ΔH=-190 kJ·mol-1。


