-
我国明代《本草纲目》中记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”“以烧酒复烧二次…价值数倍也”。这里用到的实验操作方法是
A. 过滤 B. 萃取 C. 分液 D. 蒸馏
难度: 中等查看答案及解析
-
“纳米材料”是粒子直径为1~ 100nm的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A. ①④⑥ B. ②③④ C. ②③⑤ D. ①③④⑥
难度: 中等查看答案及解析
-
下列物质属于纯净物的是
A. 精盐 B. 蒸馏水 C. 盐酸 D. 漂白粉
难度: 简单查看答案及解析
-
下列各组物质中,依次属于单质、酸、盐的一组是
A. 液氯、硝酸、纯碱 B. 干冰、石灰石、氧化钙
C. 钠、烧碱、食盐 D. 氧气、盐酸、熟石灰
难度: 简单查看答案及解析
-
下列物质可一步转化生成盐的组合是
①金属 ②非金属 ③碱性氧化物 ④酸性氧化物 ⑤酸 ⑥碱
A. 只有①②④ B. 只有②⑤⑥ C. 只有③④⑥ D. 全部
难度: 中等查看答案及解析
-
下列实验基本操作中,正确的是
A.
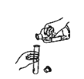 B.
B. 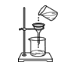 C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列反应中属于氧化还原反应,但不属于四种基本反应类型的是
A. CuO + H2
Cu + H2O B. 2KMnO4
K2MnO4 + MnO2+O2↑
C. Fe2O3 + 3CO
2Fe + 2CO2 D. NaOH + HCl = NaCl + H2O
难度: 简单查看答案及解析
-
下列化学用语不正确的是
A. 核素37Cl的中子数是20
B. 16O和18O互为同位素
C. Na+的结构示意图:
D. 硫酸的电离方程式:H2SO4=2H+ + SO42-
难度: 中等查看答案及解析
-
下列物质中,体积为22.4L的是
A. 20℃时18 g水 B. 常温常压下1 mol氨气
C. 标准状况下含6.02×1023个原子的氯气 D. 标准状况下44 g二氧化碳
难度: 简单查看答案及解析
-
下列叙述中正确的是
A. 2 mol水的摩尔质量为36g/mol
B. 摩尔是用来衡量微观粒子多少的一种物理量
C. 阿伏加德罗常数约为6.02×1023mol-1
D. 1mol·L-1的Na2SO4溶液中,含Na+的个数为2NA
难度: 简单查看答案及解析
-
某元素R的原子的质量数为70,其核内中子数为39,它的离子有28个电子,则此元素的氧化物的化学式应为
A. RO B. R2O3 C. RO2 D. R2O5
难度: 中等查看答案及解析
-
下列关于氯水的叙述不正确的是
A. 新制氯水中只含Cl2和H2O两种分子
B. 新制氯水可使蓝色石蕊试纸先变红后褪色
C. 光照氯水有气泡产生,该气体是O2
D. 氯水长时间放置后酸性增强
难度: 中等查看答案及解析
-
下列有关物质体积的叙述中,正确的是
A. 气体摩尔体积是指1mol任何气体所占的体积为22.4L
B. 若气体摩尔体积为22.4 L/mol,则所处条件一定为标准状况
C. 一定温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
D. 同质量、不同密度的CO和N2它们所占的体积不相等,所含分子数也不相等
难度: 简单查看答案及解析
-
同温同压下两个容积相等的贮气瓶,一个装有C2H4气体,另一个装有C2H2和C2H6的混合气体,两瓶内的气体可能不相同的是
A. 物质的量 B. 原子总数 C. 碳原子数 D. 分子数
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 强电解质溶液导电能力一定强
B. 氧化还原反应的本质是元素化合价的升降
C. 阳离子只有氧化性,阴离子只有还原性
D. 氧化还原反应中,某元素由化合物变为单质,此元素可能被还原也可能被氧化
难度: 简单查看答案及解析
-
如图所示,A处通入干燥的Cl2,打开B阀后,C处的湿润红布条逐渐褪色;关闭B阀时,C处的湿润红布条无明显现象。则D瓶中装的是
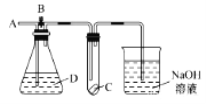
A. 浓硫酸 B. NaOH溶液
C. 浓盐酸 D. 饱和NaCl溶液
难度: 中等查看答案及解析
-
已知反应: Co2O3 + 6HCl(浓)= 2CoCl2+ Cl2↑ + 3H2O 。下列说法正确的是
A. HCl是氧化剂
B. Cl2被氧化,发生氧化反应
C. 还原性:CoCl2 > HCl
D. 该反应生成标准状况下11.2L Cl2,转移NA个电子
难度: 中等查看答案及解析
-
下列实验原理、方法和结论都正确的是
A. 向饱和FeCl3溶液中滴加NaOH溶液可制得Fe(OH)3胶体
B. 将Cl2和HCl混合气体通过饱和食盐水可得到纯净的Cl2
C. 分液时,放出分液漏斗下层液体后,上层液体从上口倒出
D. 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
难度: 中等查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A. 向某溶液中滴加NaOH溶液并微热,用湿润的红色石蕊试纸置于试管口试纸变蓝色,一定有NH4+
B. 加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ca2+
C. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
D. 用洁净的铂丝蘸取待测液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,则该溶液中一定含有钾离子,一定不含有钠离子
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法不正确的是
A. 1mol过氧化钠与水完全反应,转移电子数为NA
B. 46g NO2与N2O4混合气体中含有原子数为3NA
C. 标准状况下,11.2LCCl4含有的分子数为0.5 NA
D. 含有0.1 NA个CO32-的Na2CO3固体的质量为10.6g
难度: 中等查看答案及解析
-
下列反应的离子方程式中,正确的是
A. 硝酸银溶液中加入铜粉: Ag++Cu =Cu2++Ag↓
B. 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
C. 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-=CH3COO-+H2O
D. 盐酸与氨水反应 :H++OH-=H2O
难度: 简单查看答案及解析
-
下列各溶液中能大量共存的离子组是
A. 碳酸氢钠溶液中:K+ NO3- Cl- OH-
B. 使酚酞试液呈红色的溶液中:Mg2+ Cu2+ SO42- K+
C. 澄清透明的溶液中:Cu2+ Mg2+ SO42- Cl-
D. 使石蕊试液变红的溶液中:Na+ Cl- K+ ClO-
难度: 简单查看答案及解析
-
在3Cl2+6NaOH=5NaCl+NaClO3+3H2O反应中,氧化产物与氧化剂的物质的量之比为
A. 2∶5 B. 1∶2 C. 5∶1 D. 2∶1
难度: 中等查看答案及解析
-
把500
有
和
的混合溶液分成5等份,取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A.
B.
C.
D.
难度: 中等查看答案及解析

