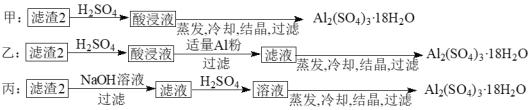
-
化学与生活密切相关,下列说法错误的是
A. 明矾可用作净水剂
B. 纯碱可用于中和过多的胃酸
C. 硫酸铜常用作游泳馆池水消毒剂
D. 硫酸钡可用于胃肠X射线造影检查
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值,下列说法正确的是
A. 2 mL 0.5 mol/L FeCl3溶液滴入沸水中制备Fe(OH)3胶体,所得胶粒数目为0.001NA
B. 标准状况下,3.36LSO3含有的电子数为6NA
C. 铁和水蒸气反应生成22.4L氢气,转移电子数为2NA
D. 将含有3NA个离子的过氧化钠固体溶于水配成1L溶液,所得溶液中Na+的浓度为 2mol/L
难度: 中等查看答案及解析
-
取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y。下列叙述中正确的是( )
A. 上述四种氧化物对应的水化物中,Al(OH)3酸性最强
B. 向沉淀X中加入氢氟酸,沉淀X不溶解
C. 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
D. 溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2
难度: 中等查看答案及解析
-
用NaCl 固体配制0.1mo/L 的NaCl 溶液1000mL,下列操作或说法正确的是( )
A. 将5.85gNaCl 固体溶于1L水中可配成0.1mol/L的NaCl 溶液
B. 称量时,将固体NaCl 直接放在天平左盘上
C. 固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水稀释到刻度线
D. 配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果
难度: 中等查看答案及解析
-
表示下列反应的离子方程式正确的是
A. 磁性氧化铁溶于稀硝酸:3Fe2++4H++ NO 3-
3Fe3++NO↑+3H2O
B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
Mn2++Cl2↑+2H2O
C. 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O
Al(OH)3↓+HCO3-
D. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3
2FeO42-+3Cl-+H2O+4H+
难度: 中等查看答案及解析
-
下列反应中,水只作氧化剂的是
①氟气通入水中 ②水蒸气经过灼热的焦炭 ③钠块投入水中
④铁与水蒸气反应 ⑤氯气通入水中
A. 只有①④ B. 只有①⑤
C. 只有②③ D. 只有②③④
难度: 中等查看答案及解析
-
下列金属冶炼的反应原理,错误的是
A. 2NaCl(熔融)
2Na+Cl2↑ B. Al2O3+3H2
2Al+3H2O
C. Fe3O4+4CO
3Fe+4CO2 D. 2HgO
2Hg+O2↑
难度: 简单查看答案及解析
-
已知还原性Cl-<Fe2+<H2O2<I-<SO2,下列反应不能发生的是
A. 2Fe3++SO2+2H2O===SO42-+4H++2Fe2+
B. I2+SO2+2H2O===H2SO4+2HI
C. H2O2+2H++SO42-===SO2↑+O2↑+2H2O
D. Cl2+2Fe2+===2Fe3++2Cl-
难度: 简单查看答案及解析
-
ClO2遇浓盐酸会生成Cl2 ,反应方程式为2ClO2 + 8HCl = 5Cl2+ 4H2O ,该反应中若转移电子的数目为9.632×1023,则产生的Cl2在标况下的体积为
A. 11.2L B. 33.6L C. 22.4L D. 44.8L
难度: 中等查看答案及解析
-
下列说法正确的是
A. 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
B. CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂物质的量之比是1∶4
C. 现代海战通过喷放液体SiCl4(极易水解)和液氨来产生烟幕,烟幕的主要成分是HCl
D. 水玻璃、有机玻璃、玛瑙、普通玻璃、陶瓷及水泥均属于硅酸盐产品
难度: 中等查看答案及解析
-
判断下列实验说法不正确的是
A. 向FeCl3溶液中滴加KSCN溶液,溶液显红色 ,可用于检验Fe3+
B. 向FeSO4溶液中滴入K3[Fe(CN)6]溶液,生成蓝色沉淀 ,可用于检验Fe2+
C. 把饱和的FeCl3溶液煮沸至红褐色 ,可用于制备氢氧化铁胶体
D. 配制FeCl3溶液时,可先将FeCl3固体溶于盐酸中
难度: 中等查看答案及解析
-
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关的推断中错误的是
A. “另一种反应物”一定具有还原性
B. CuH既可做氧化剂也可做还原剂
C. CuH+Cl2=CuCl+HCl(燃烧)
D. CuH+HCl=CuCl+H2↑(常温)
难度: 困难查看答案及解析
-
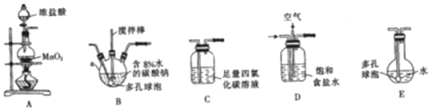
按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
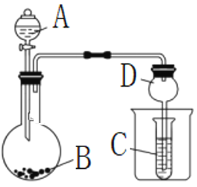
A. 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为CaCO3,C中盛Na2SiO3,则C中溶液中变浑浊
C. 实验仪器D可以起到防止溶液倒吸的作用
D. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
难度: 困难查看答案及解析
-
在前一种分散系中慢慢滴加后一种试剂,能观察到先沉淀后变澄清的是
①向氯化铝溶液中滴加氢氧化钠溶液 ②向偏铝酸钠溶液中加盐酸
③向氢氧化钠溶液中滴加氯化铝溶液 ④向蛋白质溶液中滴入硫酸铜溶液
⑤向氯化铝溶液中滴加氨水 ⑥向硝酸银溶液中滴加氨水
⑦向氢氧化铁胶体中滴加硫酸
A. ①②⑥⑦ B. ②③⑤⑦
C. ①②⑥ D. ③④⑤⑥
难度: 中等查看答案及解析
-
下列实验方法、操作及分析不正确的是
序号
操作及现象
结论
A
向溴水中加入少量苯,振荡静置后水层为无色
苯与Br2发生了加成反应
B
某气体使湿润的淀粉KI试纸变蓝
该气体可能是NO2
C
向碳酸钠溶液中加入硫酸,将产生的气体直接通入Na2SiO3溶液中,溶液产生白色胶状物质
非金属性:S>C>Si
D
常温下,将Al片和浓硝酸混合,用排水法几乎收集不到气体
Al和浓硝酸钝化
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2)∶n(NO)=1∶1时。下列说法正确的是
A. 1molCu2S参加反应时有8mol电子转移
B. 参加反应的n(Cu2S)∶n(HNO3)=1∶5
C. 反应中Cu2S既作氧化剂,又作还原剂
D. 产物n[Cu(NO3)2]∶n[CuSO4 ]=1∶1
难度: 中等查看答案及解析