-
根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A. K层电子为奇数的所有元素所在族的序数与该元素原子的K 层电子数相等
B. L层电子为偶数的所有主族元素所在族的序数与该元素原子L 层电子数相等
C. L层电子为奇数的所有主族元素所在族的序数与该元素原子L层电子数相等
D. M层电子为奇数的所有主族元素所在族的序数与该元素原子M层电子数相等
难度: 中等查看答案及解析
-
以下电子排布式是基态原子的电子排布的是( )
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
A. ①② B. ①③ C. ②③ D. ③④
难度: 中等查看答案及解析
-
某元素原子的原子核外有三个电子层,K层电子数为a,L层电子数为b,M层电子数为b-a,该原子核内的质子数是(
A. 14 B. 15 C. 16 D. 17
难度: 中等查看答案及解析
-
氨气分子空间构型是三角锥形而甲烷是正四面体型,这是因为:( )
A. 两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化。
B. NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C. NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D. 氨气分子是极性分子而甲烷是非极性分子。
难度: 简单查看答案及解析
-
金属晶体的形成是因为晶体中存在( )
A. 脱落价电子后的金属离子间的相互作用
B. 金属原子间的相互作用
C. 脱落了价电子的金属离子与脱落的价电子间的相互作用
D. 金属原子与价电子间的相互作用
难度: 中等查看答案及解析
-
在第n电子层中,当它作为原子的最外电子层时,能容纳的最多电子数与n-1层相同,当它作为原子的次外层时,其电子数比n+1层最多能多10个,则此电子层是( )
A. K层 B. L层 C. M层 D. N层
难度: 中等查看答案及解析
-
自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列实验一定能说明CaF2是离子晶体的是( )
A. CaF2难溶于水,其水溶液的导电性极弱
B. CaF2的熔、沸点较高,硬度较大
C. CaF2固体不导电,但在熔融状态下可以导电
D. CaF2在有机溶剂(如苯)中的溶解度极小
难度: 中等查看答案及解析
-
下列事实不能用键能的大小来解释的是( )
A. N元素的电负性较大,但N2的化学性质很稳定
B. 惰性气体一般难发生反应
C. HF、HCl、HBr、HI的稳定性逐渐减弱
D. F2比O2更容易与H2反应
难度: 中等查看答案及解析
-
某元素原子的电子排布式为1s22s22p63s23p1,该元素最可能的化合价为( )
A. +1价 B. +3价 C. +5价 D. -5价
难度: 中等查看答案及解析
-
下列分子中存在π键的是
A. H2 B. Cl2 C. N2 D. HCl
难度: 中等查看答案及解析
-
短周期非金属元素X和Y能形成XY2型化合物,下列有关XY2的判断不正确的是( )
A. XY2一定是分子晶体
B. XY2的电子式可能是:
: :X: :
:
C. XY2水溶液不可能呈碱性
D. X可能是ⅣA,ⅤA或ⅥA族元素。
难度: 中等查看答案及解析
-
下列描述中正确的是( )
A. CS2为V形的极性分子 B.
的空间构型为平面三角形
C. SF6中有4对完全相同的成键电子对 D. SiF4和
的中心原子均为sp3杂化
难度: 中等查看答案及解析
-
已知A、B、C、D四种短周期元素在周期表中的相对位置如右表,其中D的原子序数是A的原子序数的3倍。A与D组成的物质是一种超硬耐磨涂层材料,图3为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构。下列有关说法正确的是
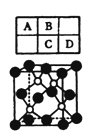
A. A与D组成的物质的化学式为BP,属于离子晶体
B. A与D组成的物质熔点高,且熔融状态下能导电
C. A与D组成的物质中原子间以共价键连接,属于原子晶体
D. A与D组成的化合物晶体中,每个A原子周围连接1个D原子
难度: 中等查看答案及解析
-
下列关于晶体的说法正确的组合是 ( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
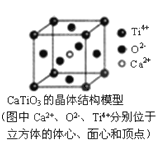
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A. ①②③⑥ B. ①②④ C. ③⑤⑦ D. ③⑤⑧
难度: 困难查看答案及解析
-
下面是第二周期部分元素基态原子的电子排布图,据此下列说法错误的是( )


A. 每个原子轨道里最多只能容纳2个电子
B. 电子排在同一能级时,总是优先单独占据一个轨道
C. 每个能层所具有的能级数等于能层的序数(n)
D. 若原子轨道里有2个电子,则其自旋状态相反
难度: 中等查看答案及解析
-
某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为
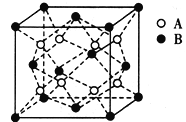
A. B2A B. BA2 C. B7A4 D. B4A7
难度: 中等查看答案及解析
-
科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子数目及核电荷的数目有关。氩原子与硫离子的核外电子排布相同,都是1s22s22p63s23p6。下列说法正确的是
A. 两粒子的1s能级上电子的能量相同
B. 两粒子的3p能级上的电子离核的距离相同
C. 两粒子的电子发生跃迁时,产生的光谱不同
D. 两粒子都达8电子稳定结构,化学性质相同
难度: 困难查看答案及解析
-
通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是
A. CH4和
是等电子体,键角均为60°
B.
和
是等电子体,均为平面正三角形结构
C. H3O+和PCl3是等电子体,均为三角锥形结构
D. B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
难度: 中等查看答案及解析
-
最近科学家成功地制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合成为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是
A. 该物质的化学式为CO4 B. 晶体的溶沸点高,硬度大
C. 晶体中C原子数与C-O化学键之比1:4 D. 晶体的空间最小环共由12个原子构成
难度: 中等查看答案及解析
-
关于电子云的叙述不正确的是( )
A. 电子云是用小点的疏密程度来表示电子在空间出现概率大小的图形
B. 电子云实际是电子运动形成的类似云一样的图形
C. 小点密集的地方电子在那里出现的概率大
D. 轨道不同,电子云的形状也不一样
难度: 中等查看答案及解析
-
下列物质的分子中既有σ键又有π键的是( )
A. HCl B. Cl2 C. C2H2 D. CH4
难度: 中等查看答案及解析
-
下列各组物质中,酸性由强到弱排列顺序错误的是( )
A. HClO4 H2SO4 H3PO4 B. HClO4 HClO3 HClO2
C. HClO HBrO4 HIO4 D. H2SO4 H2SO3 H2CO3
难度: 中等查看答案及解析
-
下列有关金属晶体的说法中不正确的是( )
A. 常温下不都是晶体
B. 最外层电子数少于3个的原子不都是金属
C. 任何状态下都有延展性
D. 都能导电、传热
难度: 中等查看答案及解析
-
下列有关配合物的论述不合理的是
A. Na[Al(OH)4]和[Ag(NH3)2]OH都是配合物
B. Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6
C. [ZnCl4]2-的空间构型为正四面体形
D. 配合物[Cr(H2O)4Br2]Br·2H2O中,中心离子的化合价为+3价,配离子带1个单位的正电荷
难度: 简单查看答案及解析
-
铝硅合金(含硅13.5%)凝固时收缩率很小,因而这种合金适合于铸造。现有下列三种晶体:①铝;②硅;③铝硅合金。它们的熔点从低到高的顺序是( )
A. ①②③ B. ②①③ C. ③②① D. ③①②
难度: 简单查看答案及解析
-
下列事实与氢键有关的是( )
A. 水加热到很高的温度都难以分解
B. 水结冰体积膨胀
C. CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高
D. HF、HCl、HBr、HI的热稳定性依次减弱
难度: 中等查看答案及解析
-
以下电子排布式表示基态原子电子排布的是( )
A. 1s22s22p63s13p3 B. 1s22s22p63s23p63d104s1 4p1
C. 1s22s22p63s23p63d24s1 D. 1s22s22p63s23p63d104s2 4p1
难度: 中等查看答案及解析
-
用高能
核轰击
m核,发生核合成反应,得到新原子
,该原子中中子数与核外电子数之差为( )
A. 161 B. 108 C. 84 D. 53
难度: 中等查看答案及解析