-
明崇祯年间《徐光启手迹》记载:“绿矾五斤,硝(硝酸钾)五斤,将矾炒去,约折五分之一,将二味同研细,次用铁作锅,……锅下起火,取气冷定,开坛则药化为强水。五金入强水皆化、惟黄金不化强水中,加盐则化。”以下说法不正确的是
A. “强 水”主 要 成 分 是 硝酸
B. “将矾炒去,约折五分之一”是指绿矾脱水
C. “锅下起火,取气冷定”描述了蒸馏的过程
D. “五金入强水皆化”过程产生的气体都是H2
难度: 简单查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入到过量NaHCO3溶液中 ④向NaAlO2溶液中滴入少量盐酸 ⑤向饱和Na2CO3溶液中通入足量CO2
A. ①③④⑤ B. 只有①④ C. 只有②③ D. 只有③④⑤
难度: 中等查看答案及解析
-
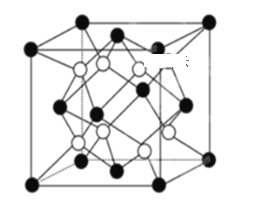
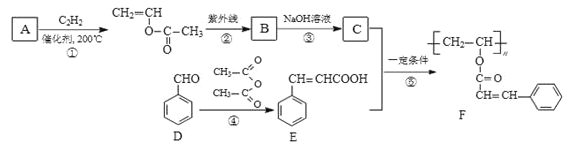
2016年诺贝尔化学奖由三位化学家共同获得,以表彰他们在研究纳米分子机器中的“马达分子”取得的成就,“马达分子”的关键组件是三蝶烯(图1)和金刚烷(图2),下列说法正确的是
A. 三蝶烯的分子式为C20H16
B. 三蝶烯属于苯的同系物
C. 金刚烷(图2)属于饱和烃
D. 三蝶烯和金刚烷的一氯代物均只有二种
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列有关叙述正确的是
A. 44gCO2与C3H8的混合物中含有共用电子对数为9NA
B. 硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA
C. 将标准状况下2.24LSO2通入水中完全溶解,溶液中HSO32-与SO32-总数为0.1NA
D. 标准状况下,8.96L的平均相对分子质量为3.5的H2与D2混合物中含中子数0.3NA
难度: 中等查看答案及解析
-
四种短周期主族元素X、Y、Z、W的原子序数依次增大。化合物甲由X、Y、Z三种元素组成,25℃时,0.01mol/L 甲溶液中的c(OH-)/c(H+)=1010;Z与W同周期,且W的最高化合价与最低化合价的代数和为4。下列说法中不正确的是
A. 等物质的量的化合物Z2Y2与Z2W的阴离子个数相同
B. 原子半径X<Y<W<Z
C. 沾有W的单质的试管可用酒精洗涤
D. 简单氢化物的稳定性Y>W
难度: 中等查看答案及解析
-
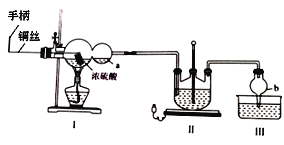
为探究硫酸亚铁的分解产物,将硫酸亚铁装入下图所示的装置a中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是
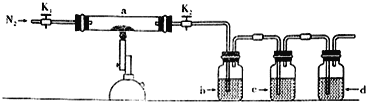
A. 分解的气体产物中有SO3、SO2 ,应该先检验SO3
B. 装置b中的试剂为Ba(NO3)2溶液,反应后有白色沉淀生成
C. 装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2
D. 装置d中的试剂为石灰水,是尾气处理装置
难度: 中等查看答案及解析
-
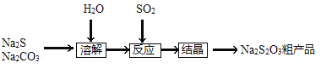
下面是用硫酸钙生产硫酸、漂白粉等一系列物质的流程图。下列说法正确的是
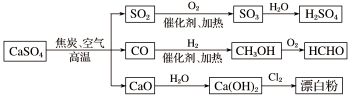
A.CO、SO2、SO3均是酸性氧化物
B.图示转化反应均为氧化还原反应
C.工业上利用Cl2和澄清石灰水反应来制取漂白粉
D.用CO合成CH3OH,原子利用率为100%
难度: 简单查看答案及解析