-
下列物质能导电,但不属于电解质也不属于非电解质的是
A. 食盐 B. 铜丝 C. 纯碱 D. 干冰
难度: 简单查看答案及解析
-
近年来人们为改善空气质量,治理雾霾而启动了“蓝天工程”,根据你所学知识,判断下列措施不利于“蓝天工程”建设的是
A. 把燃煤的火力发电厂的烟囱造高,减少酸雨的污染
B. 实施绿化工程,防治扬尘污染
C. 发展新能源汽车,减少传统燃油车的尾气污染
D. 推广使用燃煤脱硫技术,有效减少SO2的污染
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 在标准状况下,NA个Br2分子所占的体积约为22.4L
B. 含NA个Na+的氧化钠溶于1L水中,所得溶液中Na+的物质的量浓度为1 mol/L
C. 1 mol Cl2发生化学反应,转移的电子数一定为2NA
D. 24 g O2分子和24 g O3分子所含的氧原子数目相等
难度: 中等查看答案及解析
-
用10.0 mL 0.1 mol·L-1 的BaCl2溶液, 可恰好分别使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全沉淀,则这三种硫酸盐溶液的物质的量浓度之比是
A. 1:1:1 B. 1:2:3 C. 2:2:1 D. 1:3:3
难度: 中等查看答案及解析
-
对于反应:NaH+H2O=== NaOH+H2↑,有下列判断:①NaOH是氧化产物;②H2只是还原产物;③H2O是氧化剂;④NaH中的氢元素被还原;⑤此反应中的氧化产物与还原产物的分子个数之比为1∶1,其中正确的是
A. ①③ B. ②④ C. ①④ D. ③⑤
难度: 中等查看答案及解析
-
某同学欲用托盘天平称量21.5g氯化钠(5g以下用游码),他把氯化钠放在右盘,砝码放在左盘,当天平两边平衡时,他所称取的氯化钠的质量实际是
A. 16.5g B. 18.5g C. 20.5g D. 23.5g
难度: 中等查看答案及解析
-
能用离子方程式“ H+ + OH = H2O”表示的化学反应是
A. KOH溶液和稀HNO3反应 B. Ba(OH)2溶液和稀H2SO4的反应
C. Cu(OH)2和盐酸的反应 D. NaOH溶液和CH3COOH反应
难度: 中等查看答案及解析
-
从1L 0.1mol/L的NaOH溶液中取出100mL,有关这100mL溶液的叙述中正确的是
A. 含NaOH质量为 4.0 g B. 物质的量浓度为0.01mol/L
C. 物质的量浓度为0.1mol/L D. 含Na+ 0.1mol
难度: 中等查看答案及解析
-
下列日常生活及化工生产中的变化与氧化还原反应无关的是
A. 煅烧石灰石制生石灰 B. 蜡炬成灰泪始干
C. 古人云:“曾青得铁则化为铜 ” D. 氢气球遇明火发生爆炸
难度: 中等查看答案及解析
-
在只含有Mg2+、Al3+、Cl、SO42四种离子的某溶液中(不考虑水的电离),已知Mg2+、Al3+、Cl的个数比为2:1:1 , 则该溶液中Al3+与SO42离子的个数比为
A. 2:3 B. 1:2 C. 1:3 D. 3:2
难度: 中等查看答案及解析
-
下列仪器中常用于物质分离的是
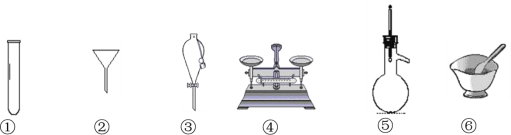
A. ①③⑤ B. ①②⑥ C. ②③⑤ D. ③④⑤
难度: 简单查看答案及解析
-
下列反应的离子方程式中正确的是
A. 铜片插入硝酸银溶液中:Cu + Ag+
Cu2+ + Ag
B. 在澄清石灰水中通入足量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
C. 碳酸镁跟醋酸反应:MgCO3+2H+
Mg2+ +H2O+CO2↑
D. 铁跟稀硫酸反应: Fe+2H+
Fe2+ + H2↑
难度: 中等查看答案及解析
-
下列各组离子在无色透明的酸性溶液中能大量共存的是
A. Mg 2+、NO3、C1、K+ B. Na+、Cu2+、Cl、SO42
C. Ca2+、Na+、NO3、MnO4 D. K+ 、Cl 、Na+ 、HCO3
难度: 中等查看答案及解析
-
为了除去氯化钾中含有的少量硫酸镁和氯化钙杂质,需进行下列六项操作,其先后顺序正确的是
①加水溶解 ②加热蒸发得到晶体 ③加入过量的氯化钡溶液
④加入适量的盐酸 ⑤加入过量碳酸钾和氢氧化钾 ⑥过滤
A. ①④③⑤⑥② B. ①③⑤⑥④② C. ①③④⑥⑤② D. ①⑤③④⑥②
难度: 中等查看答案及解析
-
火法炼铜首先要焙烧黄铜矿,其反应方程式为: 2CuFeS2 + O2 === Cu2S + 2FeS + SO2 ,下列说法中正确的是 ( )
A. SO2只是氧化产物
B. CuFeS2仅作还原剂,硫元素被氧化
C. 每生成1 molCu2S,有4 mol S原子被氧化
D. 每有1 mol S原子被氧化,则转移6 mol电子。
难度: 中等查看答案及解析
