-
(1)有一无色透明的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl—、Mg2+、Ba2+、NO3—、CO32-、SO42-,现取出三份该溶液分别进行下列实验:
①第一份中加入AgNO3溶液有白色沉淀;
②第二份中加入足量NaOH溶液加热后,只收集到刺激性气味的气体,无其他明显现象;
③第三份中加入BaCl2溶液后,有白色沉淀。将白色沉淀转移入足量的稀盐酸中,发现沉淀部分溶解。
则该混合溶液中,一定存在的离子有_____________________________,肯定不存在的离子有_________________________,(填离子符号),写出实验③中沉淀部分溶解的离子方程式为_________________________________________________________。
(2)今有下列三个氧化还原反应:
① 2FeCl2 + Cl2 == 2FeCl3 , ② 2FeCl3 + 2KI == 2FeCl2 + 2KCl + I2 ,
③ 2KMnO4 + 16HCl == 2KCl + 2MnCl2 + 8H2O + 5Cl2↑。
反应②的离子方程式为:____________________________________,其中____________是氧化剂,_______________是氧化产物; 当反应③中有14.6gHCl消耗掉时,反应中转移的电子数为______________________________ 个。从上述三个反应可判断出 Fe2+、Cl—、I—、Mn2+ 的还原性由强到弱的顺序是________________________________。
高一化学综合题中等难度题查看答案及解析
-
某无色透明酸性溶液中可能含有K+、Fe2+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-、NO3-中的若干种离子。某同学取50 mL的溶液进行如下实验:
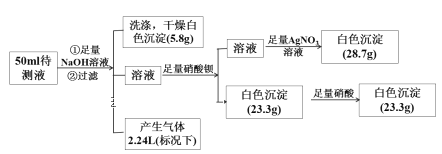
回答下列问题:
(1)原溶液中肯定存在的离子是____________ ,肯定不存在的离子是______________ 。
(2)原溶液中可能存在的离子是______________ 。
(3)原溶液中Cl-的浓度为______________ 。
(4)原溶液中c(K+)范围:_______________ (若不存在,说明理由)
高一化学推断题困难题查看答案及解析
-
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100 mL溶液进行如下实验: ①第一份加足量AgNO3溶液后,有白色沉淀产生
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图
根据上述实验,以下推测不正确的是( )
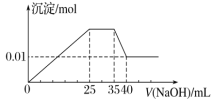
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 实验所加的NaOH的浓度为2 mol/L
D. 原溶液一定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n(NH4+)=1∶1∶2
高一化学单选题困难题查看答案及解析
-
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。[
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
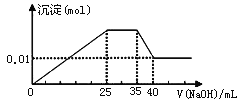
A.原溶液一定不存在H+、Cu2+、CO32-
B.不能确定原溶液是否含有K+、NO3-
C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
D.实验所加的NaOH的浓度为2mol·L-1
高一化学单选题困难题查看答案及解析
-
某无色济液中,只可能含有以下离子中的若干种: NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g
③第三份逐滴滴加 NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,试回答下列问题:
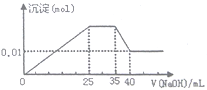
(1)该溶液中一定不存在的阴离子有_______。
(2)实验③中NaOH溶液滴至35mL后发生的离子方程式为_______________________________。
(3)原得液确定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n(NH4+)=___________。
(4)实验所加的NaOH溶液的浓度为________。
(5)溶液中存在一种不能确定的阳离子, 请设计实验方案加以检验_________________________。
(6)原溶液中NO3-的浓度为c(NO3-)则c(NO3-)的最小浓度为_________。
高一化学综合题中等难度题查看答案及解析
-
有一未知的无色溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
①第一份加入足量AgNO3溶液后,有白色沉淀产生。
②第二份加入足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图所示。
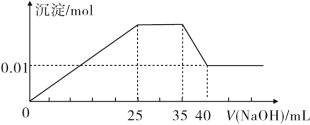
根据上述实验,完成下列问题:
(1)原溶液中一定不存在的离子是______________。
(2)25~35段发生反应的离子方程式为__________。
(3)35~40段发生反应的离子方程式为__________。
(4)实验所加的NaOH的浓度为________。
(5)原溶液中NO3-的物质的量为n(NO3-),根据提供的图像和数据,试计算n(NO3-)的取值范围为________。
高一化学填空题中等难度题查看答案及解析
-
有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Al3+、Fe3+、Cu2+、NO3-、CO32-、SO42-):现取两份100mL溶液进行如下实验:
①第一份加入足量的BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,称量沉淀质量为4.66g;
②第二份逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如图所示。
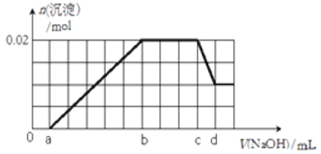
根据上述实验事实,回答以下问题:
(1)该溶液中一定不存在的阳离子有_____和______。
(2)在实验②中,NaOH溶液滴至b~c段过程中发生的离子反应方程式为___________;NaOH溶液的浓度为_____(用字母c、d表示);
(3)原溶液确定含有Mg2+、Al3+、H+,其物质的量之比n(Mg2+):n(Al3+):n(H+)为_____;
(4)原溶液中NO3-的浓度为c(NO3-),则c(NO3-)的取值范围______________。
高一化学综合题中等难度题查看答案及解析
-
下列离子能大量共存的是
A.使酚酞溶液呈红色的溶液中:NH4+、K+、SO42-、CO32-
B.无色透明的溶液中:Mg2+、K+、SO42-、NO3-
C.含有大量Ba2+的溶液中:Na+、Cu2+、SO42-、Cl-
D.使石蕊溶液呈红色的溶液中:NH4+、K+、CO32-、NO3-
高一化学单选题中等难度题查看答案及解析
-
在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
阳离子
K+ Ag+ Mg2+ Ba2+ Fe3+
阴离子
NO3- CO32- SiO32- SO42-
提示:SiO32-+2H+=H2SiO3↓(H2SiO3是白色沉淀)、H2SiO3
SiO2+H2O
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号
实验内容
实验结果
Ⅰ
向该溶液中加入足量稀盐酸
产生白色沉淀并放出标准状况下0.56 L气体
Ⅱ
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量
固体质量为2.4 g
Ⅲ
向Ⅱ的滤液中滴加BaCl2溶液
无明显现象
请回答下列问题。
(1)通过以上实验能确定一定不存在的阳离子是______,一定不存在的阴离子是________。
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)
阴离子
①___
②___
c/mol·L-1
____
___
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_______________。
高一化学填空题困难题查看答案及解析
-
某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-、CO32-。取该溶液进行如下实验:
①取溶液少许,滴入AgNO3溶液产生白色沉淀;
②另取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解;
③另取原溶液500mL,加入过氧化钠固体,产生的沉淀的物质的量与加入过氧化钠的物质的量的关系如下图所示。
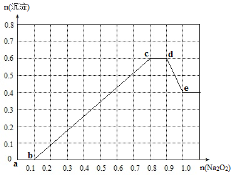
根据实验现象和数据分析,回答下列问题:
(1)de段发生的反应的离子方程式是 ;
(2)溶液中肯定存在的离子是 (用离子符号表示);
(3)溶液中可能存在的离子是 (用离子符号表示);
(4)原溶液中金属阳离子的浓度分别为 ;
(5)请在答题卡对应图上画出加入过氧化钠从0~1.1mol时,产生气体的物质的量随加入过氧化钠物质的量变化的曲线(假设生成的气体全部逸出)。
高一化学推断题中等难度题查看答案及解析