-
其元素的原子核外电子排布中,K 电子层和L 电子层电子数之和等于M 电子层和N 电子层的电子数之和,则该元素的核电荷数为
A. 12 B. 17 C. 20 D. 30
难度: 简单查看答案及解析
-
东汉魏伯阳在《周易参同契》中对汞的描述:“…………得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的“黄芽”是指
A. 金 B. 硫 C. 铜 D. 铁
难度: 简单查看答案及解析
-
下列物质中,有极性共价键的是
A. 水 B. 氯化镁 C. 过氧化钠 D. 单质碘
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A. 溴化铵的电子式:
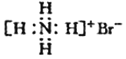 B. 次氯酸分子的结构式: H-O-Cl
B. 次氯酸分子的结构式: H-O-ClC. 氨气分子的电子式:
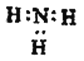 D. 氯化钠的分子式: NaCl
D. 氯化钠的分子式: NaCl难度: 简单查看答案及解析
-
下列性质的递变规律正确的是
A. 酸性: HClO4<HBrO4< HIO4
B. 还原性: Cl->Br->I-
C. Al3+、Mg2+、Na+的离子半径依次减小
D. F2、Cl2、Br2、I2的熔沸点依次升高,密度依次增大
难度: 中等查看答案及解析
-
HgCl2的稀溶液可用作手术刀的消毒剂,已知熔融的HgCl2不导电,而HgCl2的稀溶液有弱的导电能力,下列关于HgCl2的叙述正确的是
A. HgCl2属于离子化合物 B. HgCl2属于共价化合物
C. HgCl2属于非电解质 D. 熔融状态下的HgCl2中存在Hg2+
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法不正确的是
A. 4.4g 由CO2和N2O 组成的混合气体中含有的原子总数为0.3NA
B. 0.1mol H2和0.1molI2 于密闭容器中充分反应后,其分子总数为0.2NA
C. 1.8g18O2中含有的中子数为NA
D. 5.6g 铁粉在2.24L( 标准状况下)氯气中燃烧,转移的电子数为0.2NA
难度: 中等查看答案及解析
-
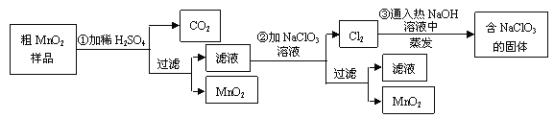
根据元素周期表和元素周期律,判断下列叙述不正确的是
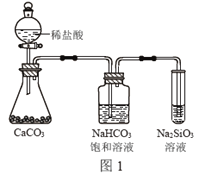
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 图1所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“
”(ào)命名的第118号元素在周期表中位于第七周期0族
难度: 中等查看答案及解析
-
A、B、C、D、E 是同一周期的五种主族元素,A和B 的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C 和D 的气态氢化物的稳定性C>D,E 是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A. BADCE B. ECDBA C. ABCDE D. CDABE
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
将氯气通入品红溶液
溶液红色褪去
氯气具有漂白性
B
将铜粉加入1.0mol•L﹣1
的Fe2(SO4)3溶液中
溶液变蓝,有黑色固体出现
金属Fe比Cu活泼
C
用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点比较低
D
向盛有少量浓硝酸、稀硝酸的两支试管中分别加入一片大小相同的铜片
浓硝酸中铜片很快开始溶解,并放出红棕色气体;稀硝酸中过一会铜片表面才出现无色气体,气体遇空气变红棕色
浓硝酸氧化性强于稀硝酸
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
A. SiH4的熔沸点比CH4 高,则PH3 的熔沸点比NH3 高
B. Al(OH)3 能溶于NaOH 溶液,则Be(OH)2能溶于NaOH 溶液
C. 钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂
D. F2在暗处遇H2 即爆炸,I2在暗处遇H2 爆炸
难度: 中等查看答案及解析
-
向Na2CO3、NaHCO3 混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是

A. a点对应的溶液中: Na+、Ca2+、SO42-、NO3-
B. b 点对应的溶液中: K+、Na+、OH-、Cl-
C. c点对应的溶液中: Na+、Ca2+、NO3-、Cl-
D. d 点对应的溶液中: Cl-、NO3-、Fe2+、Na+
难度: 中等查看答案及解析
-
如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
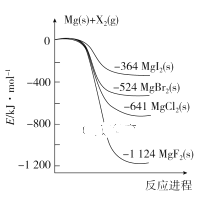
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s)+Cl2(g)===MgCl2(s)+Br2(g) ΔH=-117 kJ·mol-1
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 储热材料是一类重要的存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量
B. Ge(32 号元素) 的单晶可以作为光电转换材料用于太阳能电池
C. 纳米铁粉可以高效地去除被污染水体中的Pb2+,Cu2+,Cd2+,Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
D. Ba2+浓度较高时危害健康,但BaSO4 可服入体内,作为造影剂用于X- 射线检查肠胃道疾病
难度: 中等查看答案及解析
-
如图所示,三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化。一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。下列判断正确的是

A. 化合物B与C 的混合物呈碱性 B. 非金属性: Z>Y>X
C. 化合物A易溶于水 D. 原子半径: Z<Y<X
难度: 中等查看答案及解析
-
元素X、Y 和Z 可结合形成常见化合物XYZ3,X、Y 和Z 的原子序数之和为26,Y和Z在同一周期,下列有关推测正确的是
A. 若XYZ3是一种可溶于水的酸,则Y 是氯元素
B. 若XYZ3是一种盐,则Y一定是硫元素
C. 若XYZ3是一种易溶于水的盐,且X与Z可形成共价化合物
D. 若XYZ3是一种微溶于水的盐,且Y 与Z可形成共价化合物
难度: 中等查看答案及解析