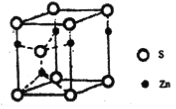
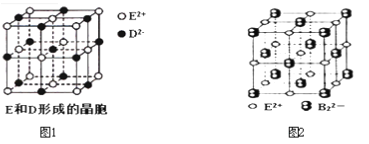
-
党的十九大报告中多次提及“绿色”、“生态文明”。下列做法不应该提倡的是
A. 分类放置生活废弃物
B. 实现化石燃料清洁利用
C. 使用聚碳酸酯类可降解塑料
D. 大量使用化肥、农药提高粮食产量
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A. CO2的分子模型示意图:
 B. 甲烷的电子式
B. 甲烷的电子式C. 硫离子核外电子排布式1s22s22p63s23p4 D. 中子数为8的碳原子
难度: 简单查看答案及解析
-
下列能正确表示基态氮原子的电子排布图的是
A.
 B.
B. 
C.
 D.
D. 
难度: 简单查看答案及解析
-
下列分子的中心原子的杂化轨道类型相同的是 ( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H4与C2H2
难度: 中等查看答案及解析
-
下列事实与氢键有关的是 ( )
A. 水加热到很高的温度都难以分解
B. 水结成冰体积膨胀,密度变小
C. CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D. HF、HCl、HBr、HI的热稳定性依次减弱
难度: 中等查看答案及解析
-
关于配合物[Cu(H2O)4]SO4,下列说法错误的是
A. 此配合物,中心离子的配位数为4
B. H2O为配体,配位原子是氧原子
C. 此配合物中,Cu2+提供孤对电子
D. 向此配合物溶液中加入BaCl2溶液,出现白色沉淀
难度: 中等查看答案及解析
-
下列结构中,从成键情况看,不合理的是
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
已知NA为阿伏伽德罗常数的值.下列说法不正确的是( )
A. 12g金刚石中平均含有2NA个σ键
B. 1molSiO2晶体中平均含有4NA个σ键
C. 12g石墨中平均含1.5NA个σ键
D. 1molCH4中含4NA个sp杂化的σ键
难度: 中等查看答案及解析
-
下列对一些实验事实的解释正确的是
选项
实验事实
解释
A
水加热到较高温度都难以分解
水分子间存在氢键
B
白磷为正四面体分子
白磷分子中P-P键间的键角是109°28′
C
用苯萃取碘水中的I2
苯和I2均为非极性分子,且苯与水互不相溶
D
H2O的沸点高于H2S
H-O键的键长比H-S键的键长短
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法中,正确的是
A. 分子组成相差一个或几个-CH2—原子团的物质互为同系物,它们的化学性质肯定相似
B. 正丁烷中4个碳原子共直线
C. 甲烷是烷烃中碳含量最低的,也是组成最简单的烃
D. 分子式为C4H10的烃有3种
难度: 简单查看答案及解析
-
下列有关同分异构体数目的叙述中,错误的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 含有5个碳原子的饱和链烃,其一氯取代物共有8种
C. 与
互为同分异构体的芳香族化合物有6种
D. 菲的结构简式为
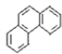 ,可有5种一氯取代物
,可有5种一氯取代物难度: 中等查看答案及解析

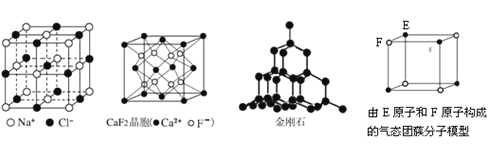

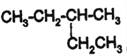 的系统命名为____________________。
的系统命名为____________________。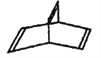
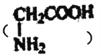 制备。
制备。