-
A、B、C、D、E是前四周期原子序数依次增大的五种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同, A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1。E元素原子的K、L层电子数之和等于其M、N层电子数之和。请回答下列各题(涉及元素请用相应化学符号表示):
(1) B、C、D三种元素中电负性最大的元素其基态原子的电子排布图为 。
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在B的基态原子中,核外存在 对自旋相反的电子。
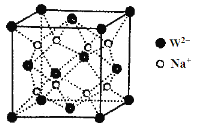
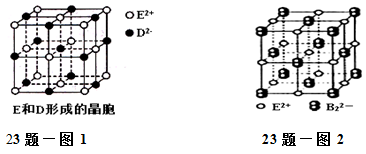
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有________个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是 。E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22-的存在,使晶胞沿一个方向拉长。晶体中E2+的配位数为______。该化合物的电子式为 。
(4)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是 。
②由H分子释放出一个电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;
-
A、B、C、D、E 是前四周期原子序数依次增大的五种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D 可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1。E 元素原子的K、L层电子数之和等于其M 、N 层电子数之和。请回答下列各题(涉及元素请请用相应化学符号表示):
(1)B、C、D 三种元素中电负性由大到小的排序为__________(用元素符号回答),其中D 元素基态原子的电子排布图为________________。
(2)在B的基态原子中,核外存在___________对自旋相反的电子。
(3)由E和D形成的晶胞如图1所示。晶体中E2+周围等距且最近的E2+有__________个; E 和B 可形成的晶体的晶胞结构与NaCl晶体的相似(如图2 所示),但该晶体中含有B22-的存在,晶体中E2+的配位数为__________,该化合物的电子式为______________。
(4)用高能射线照射液态H时,一个H 分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若千H 分子形成的“网”捕获。你认为H分子间能形成“网”的原因是________________。
②由H 分子释放出一个电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2 的水溶液反应的离子方程式__________________。
-
A、B、C、D、E是前四周期原子序数依次增大的五种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同, A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1。E元素原子的K、L层电子数之和等于其M、N层电子数之和。请回答下列各题(涉及元素请用相应化学符号表示):
(1) B、C、D三种元素中电负性最大的元素其基态原子的电子排布图为 。
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在B的基态原子中,核外存在 对自旋相反的电子。
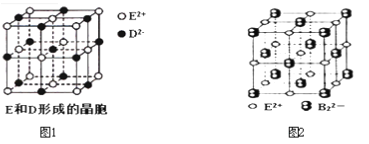
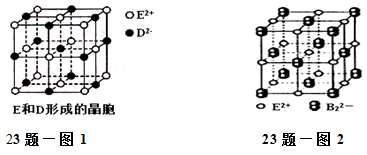
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有________个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是 。E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22-的存在,使晶胞沿一个方向拉长。晶体中E2+的配位数为______。该化合物的电子式为 。
(4)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是 。
②由H分子释放出一个电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;
-
A、B、C、D、E是前四周期原子序数依次增大的五种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1。E元素原子的K、L层电子数之和等于其M、N层电子数之和。请回答下列各题(涉及元素请用相应化学符号表示):
(1)BCD三种元素中电负性最大的元素其基态原子的电子排布图为____________;
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在B的基态原子中,核外存在____________对自旋相反的电子。
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有______个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色所对应,其原因是____________;E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22-的存在,使晶胞沿一个方向拉长。晶体中E2+的配位数为_______。该化合物的电子式为_______。

(4)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因____________;
②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,请写出该阳离子与SO2的水溶液所对 应的离子方程式________________________________________。
-
有U、V、W、X、Y、Z六种前四周期元素,原子序数依次增大,其相关信息如下表:
| 元素编号 | 相关信息比 |
| U | 所处的周期数、族序数分别与其原子序数相等 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| W | 基态时, 2p 轨道处于半充满状态 |
| X | 自然界中含量最多 |
| Y | 是第四周期元素中未成对电子数最多的元素 |
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:________________________(用元素符号表示)
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:_________,中心原子的杂化方式为:_______________;
(3)Y的基态原子的价电子排布图为____________________________;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙______丙(填“>”或“<”),原因是__________________________________________;
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于____________晶体
-
Q、T、X、Y、Z、W六种元素为前四周期原子序数依次增大的元系,其中Q元素的氢化物的水溶液pH>7;元素X、Y位于同一主族,元素X基态原子核外电子处于三个不同的能级,且s能级的电子总数比p 能级的电子总数少1。元素Z位于IVB,元素W的基态原子内层电子全充满,最外层电子数为3。(请用对应的元素符号回答相关问题)
(1)写出W的基态原子的价电子排布式: _________.
(2)Q、T、X的第一电离能由大到小的顺序为__________________。
(3)化合物Y2T的空间构型为_________,中心原子的价层电了对数为___________单质Y与湿润的Na2CO3 反应可制备Y2T,其化学方程式为_________。
(4)Q的氢化物极易溶于水,其主要原因是_________。
(5)已知Z3+可形成配位数为6的配合物。现有含2的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种品体的组成皆为ZCl3•6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为_______。
-
A、B、C、X、Y、Z、E为前四周期元素,且原子序数依次增大。A原子核外有三个能级,且每个能级上的电子数相等,C原子成对电子数是未成对电子数的3倍,X、Y、Z、E是位于同一周期的金属元素,X、E原子的最外层电子数均为1,Y有“生物金属”之称,Y4+和氩原子的核外电子排布相同,Z原子核外电子的运动状态数目是最外层电子数的14倍。用元素符号回答下列问题:
(1)B的电子排布式:_____________,Y的价电子排布图____________,Z2+的价电子排布式____________。
(2)E元素位于周期表第________周期__________族_________区。
(3)①A、B、C三种元素的第一电离能由小到大的顺序为_____________。
②A、C元素气态氢化物的稳定性的大小_________>________(分子式表示)原因_____________。
③与AC32-互为等电子体的离子_______(写一种),写出与ABC-离子互为等电子体的分子的化学式:______(写一种)。
④AC2的电子式___________。
-
X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。
请回答下列问题:
(1)X元素在周期表中的位置是____;W2+离子的外围电子排布式为___。
(2)X 能与氢、氮、氧三种元素构成化合物 XO(NH2)2,其中X原子和N原子的杂化方式为分别为___、___,该化合物分子中的π键与σ键的个数之比是____;该物质易溶于水的主要原因是___。
(3)已知Be和Al元素处于周期表中对角线位置,化学性质相似,请写出Y元素与Be元素两者相应的最高价氧化物对应水化物相互反应的化学方程式:____。
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子的配位数是___。某M配合物的化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是____。
(5)Y离子和Z离子比较,半径较大的是___(填离子符号),元素Y与元素Z形成的晶体的晶胞结构是如图所示的正方体,每个Y离子周围与它最近的Y离子有___个。
-
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________;
(2)化合物X2W2中W的杂化方式为___________,ZW2-离子的立体构型是___________;
(3)Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________;
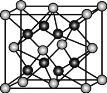
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。
-
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q+核外电子排布式为__________________。
(2)ZX3分子的空间构型为__________________, ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_______(填化学式),原因是_____________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为:______________________________________________。
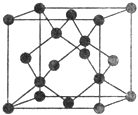
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为________(填化学式)。Na+的配位数为________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。