-
物质的量浓度相同的以下溶液:①NH4HSO4 ②(NH4)2CO3 ③NH4Fe(SO4)2 ④NH4NO3 ⑤CH3COONH4,c(NH4+)由大到小的顺序为
A. ②①③④⑤ B. ③①④②⑤ C. ①③④⑤② D. ②①④⑤③
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中一定能大量共存的是)
①pH=0的溶液:Na+、I-、NO3-、SO42-
②pH=12的溶液中:CO32-、Na+、NO3-、S2-、SO32-
③水电离H+浓度c(H+)=10-12 mol/L-1溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、
A. ②④ B. 只有② C. ①②⑤ D. ①②⑥
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 中和等体积等浓度的醋酸和盐酸,醋酸需要的氢氧化钠溶液更多
B. pH=3的醋酸溶液,稀释至10倍后pH=4
C. pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH>7
D. pH均为3的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多
难度: 中等查看答案及解析
-
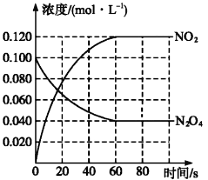
已知反应:A(g)+2B(g)=2C(g)+D(g)在四种不同情况下的化学反应速率分别为:①v (A)=0.15mol/(L·s) ②v(B)=0.4mol/(L·s) ③v(C)=0.3mol/(L·s) ④v(D)=0.5mol/(L·s)则四种情况下反应进行的快慢顺序为
A. ②>④>③>① B. ④>③=②>① C. ④>②>③=① D. ④>③>①>②
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡状态,下列叙述正确的是
A. 向水中加入稀氨水,水的电离平衡将逆向移动,氢氧根离子浓度降低
B. 向水中加入少量固体硫酸氢钠,氢离子浓度增大,Kw不变
C. 向水中加入少量固体醋酸钠,水的电离平衡逆向移动,氢离子浓度降低
D. 将水加热,Kw增大,水的电离平衡不移动,pH不变
难度: 中等查看答案及解析
-
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:v(H2)=0.45mol/(L•s),则2s末NH3的浓度为
A. 0.45mol/L B. 0.50mol/L C. 0.55mol/L D. 0.60mol/L
难度: 简单查看答案及解析
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(g)+B(g)
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法: ① 用物质 A 表示的反应的平均速率为 0.3 mol·(L·s)-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·(L·s)-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1 其中正确的是
A. ①③ B. ①④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
A. ②④ B. ①③ C. ③④ D. ①④
难度: 简单查看答案及解析
-
在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g)
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min
2
4
10
12
n(Y)/mol
1.40
1.10
0.40
0.40
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol• L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
难度: 中等查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
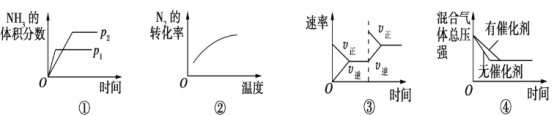
A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
难度: 中等查看答案及解析
-
在恒温恒容容器中发生反应2SO2(g)+O2(g)
2SO3(g)△H<0,下列说法不正确的是
A. 容器内压强不再变化,说明反应达到平衡状态
B. 当c(SO2):c(O2)=1:2且保持不变,能表明反应达到平衡状态
C. 加入合适的催化剂可显著增大反应速率
D. 达到平衡状态时,相同时间内,每消耗2molSO3的同时生成1molO2
难度: 中等查看答案及解析
-
下列各化合物中,均为弱电解质的一组是
A. H2CO3 Ba(OH)2 K2S H3PO4 B. FeCl3 HCl C2H5OH NH4Cl
C. CH3COOH H2CO3 Cu(OH)2 H2O D. HCl KNO3 H2CO3 H2SO4
难度: 简单查看答案及解析
-
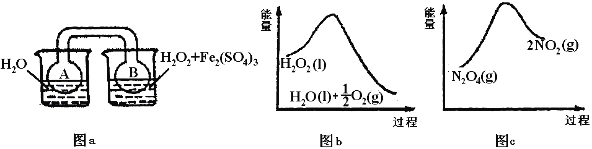
对于MgCl2 溶液和 FeCl3溶液的有关说法,不正确的是
A. 配制FeCl3溶液时,为了防止溶液出现浑浊,可以向溶液中滴入少量盐酸
B. 为了除去MgCl2酸性溶液中的FeCl3,可在加热搅拌的条件下加入MgCO3,过滤后,再向滤液中加入适量盐酸
C. 向FeCl3溶液加FeCl3固体,水解平衡正向移动,FeCl3水解程度增大
D. 向FeCl3溶液加水,溶液颜色变浅,FeCl3水解程度增大
难度: 中等查看答案及解析
-
常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是
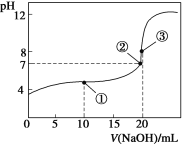
A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. 点③所示溶液中:NaOH与CH3COOH恰好完全中和,溶液呈中性
D. 在0.1000 mol·L-1 CH3COOH溶液中,由水电离出来的c(H+)= 10-13 mol·L-1
难度: 中等查看答案及解析