-
古“丝绸之路”我国商人运出的货物有:①丝绸、②茶叶、③白糖、④瓷器、⑤纸张、⑥植物油、⑦明矾、⑧金银铜器等。下列说法正确的是
A. ④、⑦、⑧都属于盐类 B. ①、⑤ 都属于高分子化合物
C. ①、②、⑤、⑥都属于蛋白质 D. ①、②、③、④、⑤、⑥的主要成分都属于有机物
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质
实际应用
A
SO2具有漂白性
SO2水溶液吸收Br2蒸气
B
ClO2具有强氧化性
自来水消毒杀菌
C
Ca(OH)2具有碱性
修复被酸雨侵蚀的土壤
D
NH3具有还原性
将烟道气中的NOx转化为N2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
某白色粉末由两种物质组成,取少量样品加入适量水中有少量气泡并有少量黄色不溶物,再向其中加入足量盐酸,固体不溶解;将上述悬浊液过滤,滤渣中加入浓硝酸并加热,固体全部溶解。则可推得该白色粉末可能为
A. Na2S2O3、NaHSO4 B. NaHCO3、KA1(SO4)2·12H2O
C. Na2SiO3、(NH4)2SO4 D. (NH4)2SO4、Ba(OH)2
难度: 中等查看答案及解析
-
铁、铜混合粉末18.0 g加入到100 mL 5.0 mol·L-1 FeCl3 溶液中,剩余固体质量为3.2 g。下列说法正确的是( )
A. 剩余固体是铁、铜混合物 B. 原固体混合物中铜的质量是9.6 g
C. 反应后溶液中n(Fe3+)=0.10 mol D. 反应后溶液中n(Fe2+)+n(Cu2+)=0.5 mol
难度: 困难查看答案及解析
-
化学与生产、生活密切相关,下列有关说法正确的是
A. 淀粉与纤维素互为同分异构体
B. 煤的气化、液化与石油的裂化、裂解均为化学变化
C. 被称为“黑金”的新型纳米材料石墨烯属于有机化合物
D. 糖类、油脂和蛋白质都属于营养物质,都能发生水解反应
难度: 简单查看答案及解析
-
只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
A. Ba(OH)2 B. H2SO4 C. NaOH D. AgNO3
难度: 中等查看答案及解析
-
下列有关铝及其化合物的性质说法正确的是
A. Al2O3熔点高,可用作耐高温材料
B. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,发现熔化后的液态铝滴落下来,所以金属铝的熔点较低
C. 把用砂纸打磨过的铝条放入浓硝酸中,产生红棕色气体
D. 把氯化铝溶液滴入浓氢氧化钠溶液中,产生大量白色沉淀
难度: 中等查看答案及解析
-
K2FeO4可用作水处理剂,它可由3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O制得。下列说法不正确的是
A. Cl2是氧化剂,Fe(OH)3在反应中失去电子
B. 氧化性:Fe(OH)3 >K2FeO4
C. 每生成l mol氧化产物转移的电子的物质的量为3 mol
D. K2 FeO4的用途与胶体和氧化剂知识有关
难度: 中等查看答案及解析
-
下列除去杂质的方法,正确的是
A. 除去Na2CO3;溶液中的少量NaHCO3:加热煮沸
B. 除去MgCl2溶液中的少量FeCl3:加入过量Fe2O3粉末,过滤
C. 除去HC1气体中的少量Cl2:通入CCl4液体,洗气
D. 除去CO2气体中的少量SO2:通入饱和食盐水,洗气
难度: 中等查看答案及解析
-
“一带一路”贸易使国外的特色产品走入百姓的日常生活,下列商品的主要成分所对应的材料类型不正确的是( )
A
B
C
D

泰国银饰

埃及棉制品

捷克水晶饰品

土耳其彩瓷
金属材料
天然高分子材料
合成高分子材料
无机非金属材料
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. CS2的电子式:
B. 次氯酸结构式:H-Cl-O
C. 中子数为16的磷原子:3116P D. 甲烷的球棍模型:
难度: 简单查看答案及解析
-
下列化工生产不涉及氧化还原反应的是( )
A. 工业合成氨 B. 工业冶炼钠 C. 工业制漂白粉 D. 侯氏制碱
难度: 简单查看答案及解析
-
在沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色。则正确的
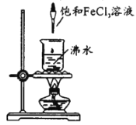
A. 用激光笔照射,会出现丁达尔效应
B. 将液体静置片刻,会出现沉淀现象
C. 所得胶体中分散质的粒子直径大于100nm
D. 可用滤纸分离提纯得到氢氧化铁胶体
难度: 中等查看答案及解析
-
同温同压下,a g甲气体和2a g乙气体所占体积之比为1∶2,根据阿伏加德罗定律判断,下列叙述不正确的是
A. 同温同压下甲和乙的密度之比为1∶1
B. 甲与乙的相对分子质量之比为1∶1
C. 同温同体积下等质量的甲和乙的压强之比为1∶1
D. 等质量的甲和乙中的原子数之比一定为1∶1
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 17g甲基(—14CH3)所含的中子数目为8NA
B. 工业合成氨时,每生成1mol NH3转移的电子数目为3NA
C. 含有1mol CO32— 的Na2CO3溶液中,Na+ 的数目为2NA
D. 足量锌与一定量浓H2SO4反应,生成1mol气体时转移的电子数目为2NA
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数的值,下列有关说法正确的是
A. 标准状况下,33.6LHF中含有氟原子的数目为1.5NA
B. 1.0L含1.0molNa2SO4水溶液中含有的氧原子数为4NA
C. 电解饱和食盐水,当阴极产生1.12L时,转移的电子数为0.1NA
D. 常温下,2L1.0mol·L-1的FeCl3溶液与1L0.2mol/L的FeCl3溶液所含Fe3+数目不同
难度: 中等查看答案及解析
-
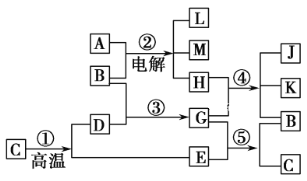
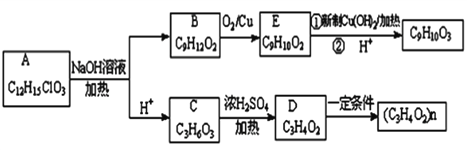
工业上制备高纯硅有多种方法,其中的一种工艺流程如下:
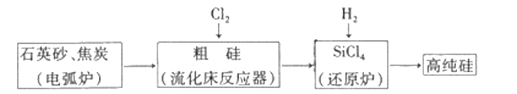
已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
难度: 中等查看答案及解析
-
四元轴烯 t、苯乙烯 b 及立方烷 c 的分子式均为 C8H8。下列说法正确的是
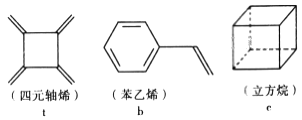
A. b 的同分异构体只有 t 和 c 两种
B. t、b、c 的二氯代物均只有三种
C. t 和b 能使酸性 KMnO4 溶液褪色而c 不能
D. t、b、c 中只有 t 的所有原子处于同一平面
难度: 中等查看答案及解析
-
下列各组物质不属于同分异构体的是
A. 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 B. 甲基丙烯酸和甲酸丙酯
C. 2-甲基丁烷和戊烷 D. 邻氯甲苯和对氯甲苯
难度: 中等查看答案及解析
-
分子式为C6H12的烃在光照下与氯气反应,生成的一氯代产物只有一种,则其结构
A. 1种 B. 2种 C. 3种 D. 4种
难度: 中等查看答案及解析
-
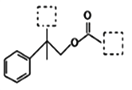
夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏。“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图。已知:苯环上卤素不水解,下列有关说法不正确的是
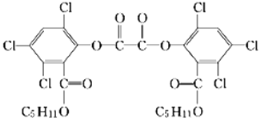
A. 草酸二酯的分子式为C26H24Cl6O8
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 1 mol草酸二酯与氢气完全反应,需要氢气6 mol
D. 1 mol草酸二酯与氢氧化钠稀溶液反应,最多消耗4 mol NaOH
难度: 中等查看答案及解析
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法不正确的是
A. X和Z的氢化物都是弱电解质
B. 化合物Y3X2溶于盐酸可得到两种盐
C. 工业上采用电解Y的氯化物制备单质Y
D. X的氢化物和Z的最高价氧化物对应的水化物形成的盐溶液pH<7
难度: 中等查看答案及解析
-
依据下列实验现象,得出的结论正确的是
操作
实验现象
结论
A
向NaBr溶液中加入氯水,再加入淀粉KI溶液
溶液变蓝
氧化性:Cl2>Br2>I2
B
将铝片放入盐酸中
产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢
H+的浓度是影响反应速率的唯一因素
C
向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热
得到蓝色溶液
蔗糖水解产物没有还原性
D
向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液
品红溶液褪色
气体中含有Cl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子检验的方法正确的是
A. 某溶液
生成无色气体,说明原溶液中有CO32-
B. 某溶液
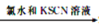 溶液变为血红色,说明原溶液中有Fe2+
溶液变为血红色,说明原溶液中有Fe2+C. 某溶液
 产生使湿润的红色石蕊试纸变蓝的气体,说明原溶液中有NH4+
产生使湿润的红色石蕊试纸变蓝的气体,说明原溶液中有NH4+D. 某溶液
 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-难度: 中等查看答案及解析
-
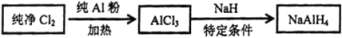
无水叠氮酸(HN3)是无色易挥发、易爆炸的油状液体,沸点308.8K,其水溶液较稳定,用于有机合成、制造雷管等。制备原理:N2H4+HNO2=HN3+2H2O。则下列说法正确的是
A. HN3分子间存在氢键,故其沸点较高,化学性质较稳定
B. 上述反应中的氧化剂是HNO2
C. N2H4为分子晶体,HN3为离子晶体
D. 上述反应中每生成1mol HN3,转移电子8/3mol
难度: 中等查看答案及解析
-
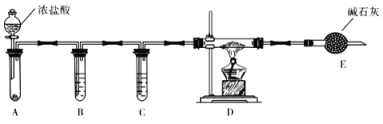
某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是( )
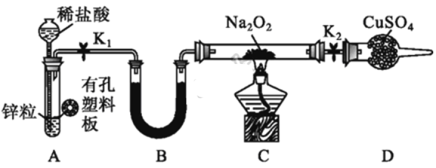
A. 装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放浓硫酸,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
难度: 中等查看答案及解析
-
某无色溶液中含有Mg2+、Al3+、Fe3+、Cu2+、NH4+、Na+中的一种或几种,取100mL该溶液,向其中不断滴加NaOH溶液,产生的沉淀随着NaOH体积变化的关系如图所示,则下列叙述不正确的是
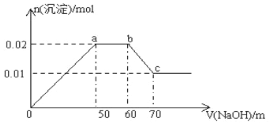
A. 该溶液中一定不含Fe3+、Cu2+
B. 该溶液中一定含有Mg2+、Al3+、NH4+,且三者物质的量浓度之比为1∶1∶1
C. 所加NaOH溶液物质的量浓度为0.1mol/L
D. a点到b点,发生的化学反应:NH4++ OH—=NH3·H2O
难度: 中等查看答案及解析