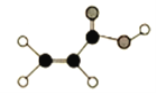
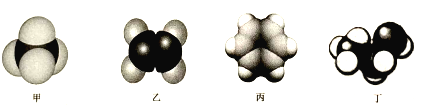
-
下列古诗中对应的化学物质及相关说法均正确的是
选项
诗句
相关物质
相关说法
A
春蚕到死丝方尽
纤维素
高分子化合物
B
蜡炬成灰泪始干
脂肪烃
饱和烃
C
沧海月明珠有泪
碳酸钙
弱电解质
D
蓝田日暖玉生烟
二氧化硅
两性氧化物
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于能量变化的说法正确的是
A. “冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B. 化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C. 已知C(石墨,s)=C(金刚石,s)ΔH>0,则金刚石比石墨稳定
D. 化学反应遵循质量守恒的同时,也遵循能量守恒
难度: 中等查看答案及解析
-
下列变化中属于原电池反应的是
A. 马口铁(镀 Sn 铁)表面有划损时,也能阻止铁被氧化
B. 在空气中金属铝表面迅速被氧化形成保护膜
C. 红热的铁丝与水接触表面形成蓝色保护层
D. 在铁与稀 H2SO4 反应时,加几滴 CuSO4 溶液,可加快 H2 的产生
难度: 中等查看答案及解析
-
化学与生产、生活社会密切相关,下列有关说法正确的是
A. 用食醋浸泡有水垢(主要成分为CaCO3) 的水壶,可以清除其中的水垢,这是利用了醋酸的氧化性
B. 白居易在《问刘十九》中有“绿蚁新醅酒,红泥小火炉”诗句,“新醅酒”即新酿的酒,在酿酒的过程中,葡萄糖发生了水解反应
C. 地沟油在碱性条件下水解可以生成高级脂肪酸盐和甘油
D. 普通玻璃和氮化硅陶瓷都属于新型无机非金属材料
难度: 中等查看答案及解析
-
在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用( )
A. NaOH B. HC1 C. NaCl D. CuSO4
难度: 简单查看答案及解析
-
为了研究影响化学反应速率的因素,甲、乙、丙、丁四位学生分别设计了如下四个实验,你认为不正确的是
A.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
B.将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,稀硫酸产生氢气快
C.将氢气和氯气的混合气体分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成
D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管再加入少量二氧化锰,产生氧气的快慢不同
难度: 中等查看答案及解析
-
对于可逆反应A(g)+3B(s)
C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. v(A)=2 mol·L-1·min-1 B. v(B)=1.2 mol·L-1·s-1
C. v(C)=0.1 mol·L-1·s-1 D. v(D)=0.4 mol·L-1·min-1
难度: 中等查看答案及解析
-
反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.
 B.
B. 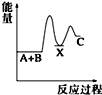
C.
 D.
D. 
难度: 中等查看答案及解析
-
下列说法不正确的是
A. C2H6和C4H10一定互为同系物
B. 等物质的量的苯和甲苯完全燃烧消耗氧气的量不相等
C. 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
D. 高聚物
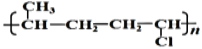 的单体是丙烯和氯乙烯
的单体是丙烯和氯乙烯难度: 中等查看答案及解析
-
下列能用勒夏特列原理解释的是
A. 钢铁在潮湿的空气中容易生锈
B. 棕红色NO2加压后颜色先变深后变浅
C. 高温及加入催化剂都能使合成氨的反应速率加快
D. H2、I2、HI平衡混合气加压后颜色变深
难度: 中等查看答案及解析
-
在一密闭容器中进行反应2SO2 + O2
2SO3,已知反应过程中某一时刻SO2、 O2、SO3的浓度分别为2 mol·L-1 、1mol·L-1 、2mol·L-1。当反应达到平衡时,容器内各物质的浓度可能为
A. SO2为4 mol·L-1、 O2为2 mol·L-1 B. SO3为4 mol·L-1
C. SO2为2.5 mol·L-1 D. SO2 、SO3为1.5 mol·L-1
难度: 中等查看答案及解析
-
关于有机物a(
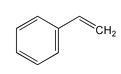 )、b(
)、b()、c(
)
A. a、b、c均能与溴水发生加成反应
B. a、b、c的分子式均为C8H8
C. a的所有原子一定处于同一一平面
D. b的二氯代物有3种
难度: 中等查看答案及解析
-
25℃、101kPa 下:
①2Na(s)+1/2O2(g)=Na2O(s) △H=-414kJ·mol-1
②2Na(s)+ O2(g)=Na2O2(s) △H=-511kJ·mol-1
下列说法正确的是 ( )
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101kPa 下:Na2O2(s)+2 Na(s)= 2Na2O(s)△H =-317kJ/mol
难度: 中等查看答案及解析
-
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)
CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
难度: 困难查看答案及解析
-
用H2O2和H2SO4的混合溶液可溶出印刷电路板中的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH已知①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1=+64 kJ·mol-1②2H2O2(l)===2H2O(l)+O2(g) ΔH2=-196 kJ·mol-1③H2(g)+1/2O2(g)===H2O(l) ΔH3=-286kJ·mol-1。下列说法不正确的是
A. 反应①可通过铜作电极电解稀H2SO4的方法实现
B. 反应②在任何条件下都能自发进行
C. 若H2(g)+1/2O2(g)===H2O(g) ΔH4,则ΔH4<ΔH3
D. ΔH=-320 kJ·mol-1
难度: 中等查看答案及解析
-
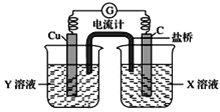
用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O
Cu2O+H2↑,装置如图,下列说法中正确的是
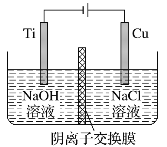
A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
难度: 中等查看答案及解析
-
咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:
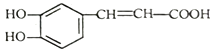
下列说法不正确的是
A. 咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B. 1mol咖啡酸最多能与4molH2反应
C. 咖啡酸分子中所有原子可能共面
D. 蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A的分子式为C8H12O
难度: 中等查看答案及解析
-
反应mX(g) +nY(g)
pZ(g) 在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间的关系如图所示。下述判断正确的是

A. T1<T2 ,P1>P2
B. T1<T2 ,m+n<p
C. m+n>p ,正反应放热
D. P1>P2,正反应吸热
难度: 中等查看答案及解析
-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
2Na2CO3+C。下列说法错误的是( )。
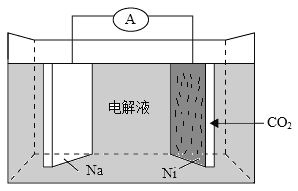
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e-=2CO32-+C
D. 充电时,正极反应为:Na++e-=Na
难度: 中等查看答案及解析
-
某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,其浓度分别为2 mol/L,1 mol/L,且发生如下反应:3A(g)+2B(g) ⇋4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5:4,则下列说法中正确的是( )
①该反应的化学平衡常数表达式为:

②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变
④增加C的量,A、B转化率不变
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析