-
t ℃时,水的离子积为Kw,该温度下将a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
A. 混合液中c(H+)=
B. 混合液的pH=7
C. a=b D. 混合液中c(B+)=c(A-)+c(OH-)
难度: 中等查看答案及解析
-
在RNH2·H2O
RNH3++OH-的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
A.通入HCl B.加少量NaOH固体 C.加水 D.升温
难度: 中等查看答案及解析
-
在常温下,中和相同体积,相同pH的Ba(OH)2、NH3·H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者关系为
A. V2>V1=V3 B. V2>V1>V3 C. V1>V2=V3 D. V1=V2=V3
难度: 简单查看答案及解析
-
室温下,pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法中正确的是
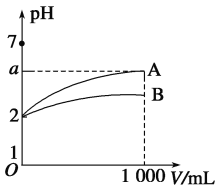
A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. 若A、B都是弱酸,则6>a>2
D. 当a=5时,A是强酸,B是弱酸
难度: 简单查看答案及解析
-
在常温下,向20 mL NaOH溶液中逐滴加入0.1 mol·L-1的醋酸溶液,滴定曲线如下图所示。下列判断中,正确的是

A. 在M点,二者恰好完全反应
B. 滴定前,酸中c(H+)等于碱中c(OH-)
C. NaOH溶液的物质的量浓度为0.1 mol·L-1
D. 在N点,c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)
难度: 中等查看答案及解析
-
下列各组离子在溶液中能大量共存的是
A. Ca2+、HCO3-、Cl-、K+ B. Al3+、AlO2-、HCO3-、Na+
C. Fe2+、H+、SO42-、S2- D. Fe3+、SCN-、Na+、CO32-
难度: 中等查看答案及解析
-
为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,该试剂是( )
A. NaOH B. MgO C. 氨水 D. Na2CO3
难度: 简单查看答案及解析
-
下列溶液在空气中加热蒸干并灼烧后,能得到相应溶质固体的是
A. AlCl3 B. KHCO3 C. Fe2(SO4)3 D. FeSO4
难度: 简单查看答案及解析
-
100 ℃,有pH分别为7、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是
A. 在三种酸HX、HY、HZ中以HX酸性相对最强
B. HX、HY、HZ三者中有一种为强酸
C. 在X-、Y-、Z-三者中,以Z-最易发生水解
D. 向1 mol HY加入NaOH充分反应至溶液呈中性时,需要的NaOH稍小于1 mol
难度: 中等查看答案及解析
-
草酸是中强酸,草酸氢钾溶液呈酸性。在0.1 mol·L-1 KHC2O4溶液中,下列关系正确的是
①c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
②c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
③c(C2O42-)>c(H2C2O4)
④c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A.①② B.①④ C.③④ D.②③
难度: 中等查看答案及解析
-
非结合胆红素(VCB)分子中有羟基,被氧化后(生成羧基)与钙离子结合形成胆红素钙的反应,就是一个沉淀生成的离子反应,从动态平衡的角度分析能预防胆结石的方法是
A. 大量食用纯碱可使钙离子沉淀完全,防止胆结石生成
B. 不食用含钙的食品
C. 适量服用低维生素E、低维生素C等抗氧化自由基可防治胆结石
D. 常喝水稀释钙离子,溶解沉淀
难度: 简单查看答案及解析
-
常温下,取一定量的PbI2固体配成饱和溶液 ,T时刻改变某一条件,离子的浓度变化如图所示,(注:第一次平衡时c(I-)=2x10-3mol/L, c(Pb2+)=1x10-3mol/L)下列有关说法正确的是
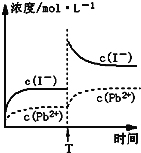
A.常温下,Ksp=2x10-6
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,c(Pb2+)不变
C.T时刻改变的条件是升高温度,PbI2的,Ksp 增大
D.常温下Ksp[PbS]=8x10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)
PbS(s)+2I-(aq)反应的化学平衡常数为5x1018
难度: 中等查看答案及解析
-
关于如图所示装置的叙述,正确的是

A. 铜是负极,铜片上有气泡产生 B. 铜离子在铜片表面被还原
C. 电流从锌片经导线流向铜片 D. 盐桥中阳离子进入左烧杯
难度: 简单查看答案及解析
-
铅蓄电池充电时,PbSO4
A.在阳极生成 B.在阴极生成
C.在两个电极上生成 D.在两个电极上除去
难度: 中等查看答案及解析