-
中国传统文化中包含许多科技知识。下列古语中不涉及化学变化的是
A. 千淘万漉虽辛苦,吹尽狂沙始到金

B. 熬胆矾铁釜,久之亦为铜

C. 凡石灰(CaCO3 ),经火焚炼为用

D. 丹砂烧之成银水,积变又成丹砂

难度: 简单查看答案及解析
-
我们的地球被大气包围着,大气质量与人类健康息息相关。下列说法不正确的是
A. 吸烟产生的尼古丁可造成室内空气污染
B. 向煤中加入适量石灰石可减少SO2的排放
C. 含放射性元素的天然建材一定不会造成室内空气污染
D. 催化转化器可有效降低汽车尾气中CO、NOx等的排放
难度: 简单查看答案及解析
-
下列说法正确的是
A. HCl的电子式为H:Cl
B. Na2O2只含有离子键
C. 质量数为12的C原子符号为12C
D. 用电子式表示KBr的形成过程:
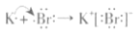
难度: 简单查看答案及解析
-
食盐在不同分散剂中形成不同分散系。
分散系1:食盐分散在水中形成无色透明溶液
分散系2:食盐分散在乙醇中形成无色透明胶体
下列说法正确的是
A. 分散系1中只有两种离子
B. 分散系2为电解质
C. 可用丁达尔效应区分两个分散系
D. 两个分散系中分散质粒子直径相同
难度: 简单查看答案及解析
-
下列解释事实的方程式正确的是
A. 用碳酸氢钠治疗胃酸过多:CO32-+2H+=CO2↑+H2O
B. 用氨水吸收烟气中的二氧化硫:SO2+2OH-=SO32-+H2O
C. 把金属钠放入冷水中产生气体:Na+2H2O=Na++20H-+H2↑
D. 用氢氧化钠溶液可以溶解氢氧化铝固体:Al(OH)3+OH-=AlO2-+2H2O
难度: 简单查看答案及解析
-
过氧化氢分解反应过程中,能量变化如图所示:下列说法正确的是
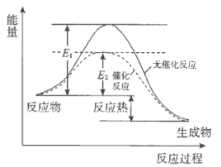
A. 催化剂可以改变过氧化氢分解反应的焓变
B. MnO2或FeCl3可以催化H2O2分解反应
C. 催化剂不能改变反应路径
D. H2O2分解是吸热反应
难度: 简单查看答案及解析
-
下列关于元素周期表应用的说法正确的是
A. 为元素性质的系统研究提供指导,为新元素的发现提供线索
B. 在金属与非金属的交界处,寻找可做催化剂的合金材料
C. 在IA、IIA族元素中,寻找制造农药的主要元素
D. 在过渡元素中,可以找到半导体材料
难度: 简单查看答案及解析
-
我国工业废水中几种污染物即其最高允许排放浓度如下表。下列说法不正确的是
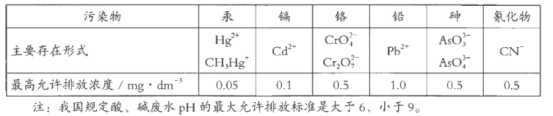
A. Hg2+、Cd2+、Pb2+是重金属离子
B. 对于pH>9的废水可用中和法处理
C. 将CrO42-转化为Cr2O72-是用氧化还原的方法
D. 在含有Hg2+的废水中加入Na2S,可使转变为沉淀而除去
难度: 中等查看答案及解析
-
将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:

下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
难度: 中等查看答案及解析
-
根据下列实验:
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是
A. 氧化性Cu2+>Fe3+
B. ①中所得固体只含铜
C. ①中滤液含有Cu2+和Fe2+
D. ②中不会观察到溶液变红
难度: 简单查看答案及解析
-
元素周期表隐含着许多信息和规律。以下所涉及的元素均为中学化学中常见的短周期元素,其原子半径及主要化合价列表如下,其中R2Q2用于呼吸面具或潜水艇中作为氧气来源。

下列说法正确的是
A. T、Z的最高价氧化物对应水化物的酸性T<Z
B. R、X、Y的单质失去电子能力最强的是X
C. M与Q形成的是离子化合物
D. M、Q、Z都在第2周期
难度: 简单查看答案及解析
-
处理含氰(CN-)废水涉及以下反应,其中无毒的OCN-中碳元素为+4价。
CN-+OH-+Cl2→OCN-+Cl-+H2O(未配平) 反应Ⅰ
2OCN-+4OH-+3Cl2=2CO2+N2+6Cl-+2H2O 反应Ⅱ
下列说法中正确的是
A. 反应I中碳元素被还原
B. 反应II中CO2为氧化产物
C. 处理过程中,每产生1 mol N2,消耗3 molCl2
D. 处理I中CN-与Cl2按物质的量比例1:1进行反应
难度: 中等查看答案及解析
-
生产硫酸的主要反应:2SO2(g)+O2(g)
2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
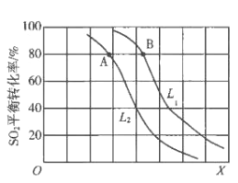
A. X代表压强
B. 推断L1>L2
C. A、B两点对应的平衡常数相同
D. 一定温度下,当混合气中n(SO2):n(O2):n(SO3)=2:1:2,则反应一定达到平衡
难度: 中等查看答案及解析
-
丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g)
C4H8(g)+H2(g)
H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[
]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
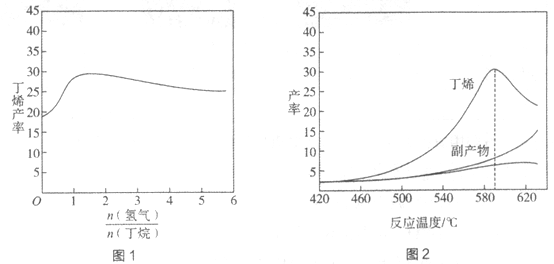
下列分析正确的是
A. 氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率
B. 丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大
C. 随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率
D. 一定温度下,控制进料比[
]越小,越有利于提高丁烯的产率
难度: 困难查看答案及解析