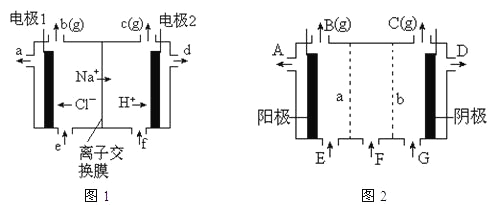
-
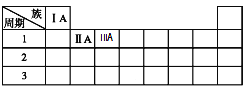
下列选项中的操作、现象与结论完全一致的是
选项
操作
现象
结论
A
A.向滴有酚酞的NaOH 溶液中通入Cl2
溶液褪色
HClO有漂白性
B
无水乙醇与浓硫酸共热至170℃,将产生气体通入溴水
溴水褪色
乙烯和溴水发生加成
C
向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞
变红,前者红色深
结合H+能力: CO32->HCO32-
D
用发光小灯泡分别做HCl和CH3COOH导电性实验
发光强度: HCl强于CH3COOH
CH3COOH是弱电解质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于有机物的鉴别方法及选用该方法的原因叙述不正确的是
序号
方法
选用该方法原因
A
用新制氢氧化铜鉴别乙醛和乙酸
新制氢氧化铜能被乙醛还原,产生砖红色沉淀,而与乙酸发生碱与酸的复分解反应产生溶解现象
B
碳酸钠溶液可鉴别乙酸、乙醇两种无色液体
碳酸钠可与乙酸发生盐与酸的复分解反应产生二氧化碳,而与乙醇不反应
C
用氯化铁溶液鉴别乙醇和苯酚
氯化铁与羟基反应显紫色
D
用水鉴别乙醇和甲苯
乙醇与水互溶,甲苯与水有分层现象
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列物质加工或应用过程中不发生化学变化的是
选项
A
B
C
D
加工或应用

纯金制金饰品

玉米酿酒
 油脂制肥皂
油脂制肥皂
氯气对自来水消毒
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 蛋白质的变性是可逆过程
B. 天然油脂没有恒定的熔点、沸点
C. 氨基乙酸不能溶于强酸溶液中
D. 蔗糖的水解产物不能发生银镜反应
难度: 简单查看答案及解析
-
已知7834 Se与O同主族,下列有关7834 Se的说法不正确的是
A. 非金属性强于S
B. 位于第四周期第ⅥA族
C. 中子数是44
D. 最高化合价为+6
难度: 中等查看答案及解析
-
2016年诺贝尔化学奖授予借助某些金属离子制造出复杂新分子,从而合成分子机器的三位科学家,合成新分子过程模拟如下:

下列有关信息错误的是
A. 图中新月形分子和环状分子“组合”在一起,铜离子起关键作用
B. 利用此方式可以合成新分子,同时也可能创造一种全新 “机械键”
C. 在创造新分子技术中,铜离子是唯一可以借助的金属离子
D. 此技术可以 “互锁”合成
分子,甚至成更复杂的分子
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是
A. 由水电离产生的c(OH﹣)=1×10﹣12mol/L的溶液中:HCO3﹣、K+、Na+、SO42﹣
B. 含有大量Fe3+的溶液中:Al3+、OH﹣、Br﹣、Na+
C. pH=0的溶液中:Na+、K+、S2-、SO32-
D. 能使酚酞变红色的溶液中:Na+、Ba2+、Cl-、Br-
难度: 中等查看答案及解析
-
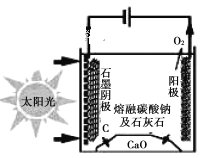
实验室根据侯氏制碱原理制备少量 NaHCO3 固体的四个主要步骤中,不能实现实验目的的是
A. 制取氨气
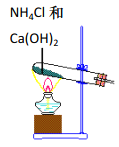 B. 制取碳酸氢钠
B. 制取碳酸氢钠 C. 分离碳酸氢钠
C. 分离碳酸氢钠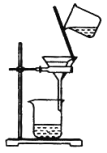 D. 干燥碳酸氢钠
D. 干燥碳酸氢钠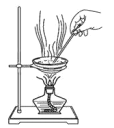
难度: 中等查看答案及解析
-
X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是
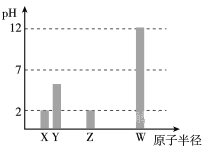
A. X是硫元素
B. Y的最高价氧化物的电子式为
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
难度: 中等查看答案及解析
-
常温下,向20 mL 0.1mol/L醋酸溶液中滴加0.1 mol/L的氢氧化钠溶液,测定结果如下图所示。下列解释不正确的是
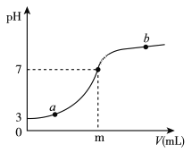
A. 0.1mol/L醋酸溶液pH约为3,说明醋酸是弱电解质
B. m大于20
C. a点表示的溶液中,c(CH3COO— )>c(Na+)
D. b点表示的溶液中,溶质为醋酸钠和氢氧化钠
难度: 中等查看答案及解析
-
下列解释事实的化学方程式或离子方程式中不正确的是
A. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-===SiO32-+H2O
B. 配制FeCl3溶液时要加盐酸:Fe3+ + 3H2O
Fe(OH)3 + 3H+
C. 燃煤时加入适量石灰石粉末,可减少SO2的排放:2CaCO3+2SO2+O2===2CaSO4+2CO2
D. 强碱溶液中,用次氯酸钠与Fe(OH)2反应制备高铁酸钠:2ClO-+Fe(OH)2===FeO42—+2Cl-+2H+
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期元素,有关这四种元素的说法中一定正确的是
元 素
X
Y
Z
W
原子半径(nm)
0.077
0.075
0.102
0.099
最高正价或最低负价
+4
+5
-2
-1
A. Y的氢化物与W的氢化物反应的产物只含有共价键
B. 1molW的单质参加氧化还原反应时转移的电子数为2mol
C. 0.3molCu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2mol气体
D. X与Z形成XZ2时各原子均满足8电子稳定结构
难度: 中等查看答案及解析
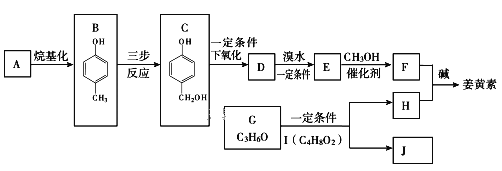
-
聚合物P的结构简式是:
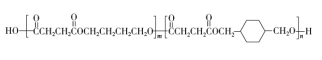 ,下列说法不正确的是
,下列说法不正确的是A. 单体之一是

B. 聚合物P 中含有酯基
C. 合成聚合物P的反应类型是缩聚反应
D. 通过质谱法测定P的平均相对分子质量,可得其聚合度
难度: 中等查看答案及解析
-
室温下,分别用0.1 mol·L-1溶液进行下列实验,结论不正确的是
A. 向NaOH溶液中通SO2至pH=7:c(Na+) = c(HSO
) +2c(SO
)
B. 向NH4HSO4加入等浓度等体积的NaOH溶液后:c(NH4+) + c(NH3·H2O) = c(Na+)
C. 向NH4Cl溶液中加入等浓度等体积的NH3·H2O后,所得溶液呈碱性,则:c(NH4+) < c(NH3·H2O)
D. 向CH3COOH溶液中加入少量CH3COONa晶体:c(CH3COO-)/c(CH3COOH) 增大
难度: 中等查看答案及解析
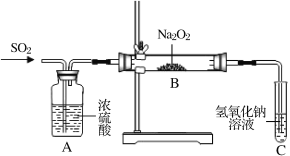
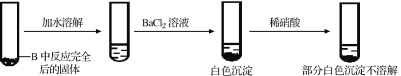
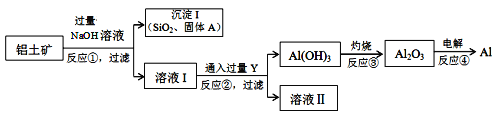
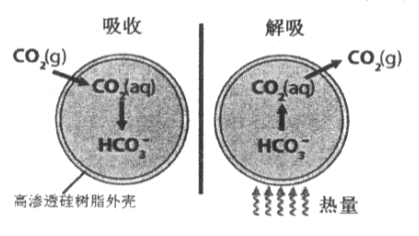
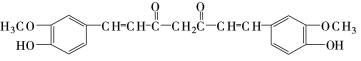
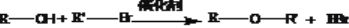 (R和R,为烃基)
(R和R,为烃基)