-
铝、氧化铝、氢氧化铝等在工业上用途广泛。
(1)用原子结构知识解释Al的金属性比Na弱:Al与Na在元素周期表中位于同一周期,_________________,Al的金属性比Na弱。
(2)结合化学用语,用化学平衡知识解释,氢氧化铝既溶于强酸溶液,又溶于强碱溶液:_______________________。
(3)Al2O3是制备二甲醚(CH3OCH3)的反应中的重要催化剂。
已知由H2、CO制备二甲醚过程为:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出由H2、CO制备二甲醚的总的热化学方程式____________。
工业上以铝土矿(主要成分是氧化铝,含氧化铁、氧化镁、二氧化硅、氧化铜等杂质)为原料提取铝、氧化铝、氢氧化铝的无机化工流程如图:
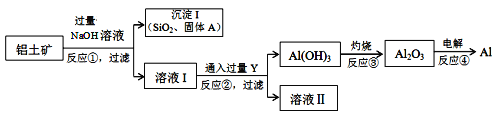
[已知:该条件下NaOH溶液与二氧化硅反应非常缓慢,在工业生产时不必考虑]
(4)固体A为________________________________。
(5)写出反应②的离子方程式为___________________________。
(6)反应④所得的铝材中,往往含有少量的铁和硅等杂质,可用电解精炼法进一步提纯,该电解池中阳极的电极反应式为__________________,下列可作阴极材料的是 ______
A.铝材 B.石墨 C.纯铝 D.铅板
(7)铝土矿中Al2O3的含量为40.8%,要使1t铝土矿中的Al2O3全部溶解理论上至少需要NaOH的质量为________t。
-
Al2O3在工业上用途广泛。
(1)Al在元素周期表中的位置 。
(2)元素X、Y均与Al位于同一周期,其中X、Y元素原子半径分别是该周期中最大的和最小的,写出XY的电子式 ,写出X元素的最高价氧化物对应的水化物与Al2O3反应的化学方程式 。
(3)Al2O3是制备二甲醚(CH3OCH3)的反应中的重要催化剂。
已知由H2、CO制备二甲醚过程为:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出由H2、CO制备二甲醚的总的热化学方程式 。
-
第ⅢA元素也称为硼族元素,除硼外其余均为金属元素。硼的应用非常广泛,可用于原子反应堆和高温技术,甚至可用来制作火箭中所用的某些结构材料。
(1)硼元素位于元素周期表第__________周期。铝与氢氧化钠溶液反应的离子方程式为_________________________。
(2)氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂(主要成分为Na2B4O7·10H2O)为起始物,经过一系列反应可以得到BN、B和BF3等。

①反应a的化学方程式为________,为了加快反应a的化学反应速率可采取的措施有_____________(回答一条即可)。
②生成BN的化学反应_________(填“是”或“不是”)氧化还原反应。
③由B2O3制硼时所得到的产品不纯,主要含有的杂质为____________。
(3)有一类硼烷形似鸟巢,故称为巢式硼烷,如下有三种巢式硼烷的结构:

①根据五硼烷和六硼烷的化学式,推测十硼烷的化学式为_____________ 。
②已知:B6H10+O2→B2O3+H2O(未配平),每1 mol B6H10完全燃烧时转移__________mol电子。
(4)NaBH4被称为“万能还原剂”,近年来常用NaBH4与过氧化氢构建一种新型碱性电池,如图所示;则该电池放电时的负极反应式为___________,正极附近溶液的pH会___________。(填“增大”、“减小”或“不变”)。

-
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业 和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期 IIIA 族,化学性质与铝元素相似。
(1)如图是当反应器中按 n(N2):n(H2)=1:3 投料后,在 200℃、400℃、600℃下,反应达到平衡时,混合物中 NH3的物质的量分数随压强的变化曲线。
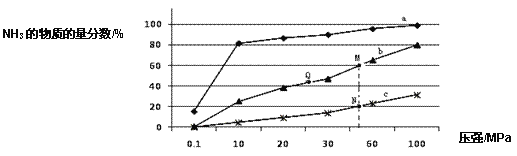
①曲线 a 对应的温度是_____________。
②关于工业合成氨的反应,下列叙述正确的是____________(填字母)。
A.及时分离出 NH3 可以提高 H2 的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中 M、N、Q 点平衡常数 K 的大小关系是 K(M) = K(Q) >K(N)
③M 点对应的 H2 转化率是____________。
(2)工业上利用 Ga 与 NH3 合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成 3 mol H2 时就会放出30.8 kJ 的热。
①该反应的热化学方程式是____________________。
②反应的化学平衡常数表达式是____________。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是____________。
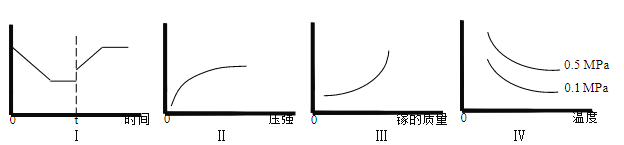
A.I 图像中如果纵坐标为正反应速率,则 t 时刻改变的条件可以为升温
B.II 图像中纵坐标可以为镓的转化率
C.III 图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的 NaOH 溶液中,该反应的离子方程式是:___________________。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液 X。己知:
| Al(OH)3 | Ga(OH)3 |
| 酸式电离常数 Ka | 2×10- 11 | 1×10- 7 |
| 碱式电离常数 Kb | 1.3×10- 33 | 1.4×10- 34 |
往 X 溶液中缓缓通入 CO2,最先析出的氢氧化物是____________。
(4)工业上以电解精炼法提炼镓的原理如下:以待提纯的粗镓(内含 Zn、Fe、Cu 杂质)为阳极,以高纯镓为阴极,以 NaOH 水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技 术到达阴极并在阴极放电析出高纯镓。
①己知离子氧化性顺序为:Zn2+<Ga3+< Fe2+<Cu2+,电解精炼镓时阳极泥的成分是____________。
②GaO2- 在阴极放电的电极方程式是___________。
-
金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1) 镓(Ga)的原子结构示意图为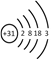 ,镓元素在周期表中的位置是_______。
,镓元素在周期表中的位置是_______。
(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,该反应的化学方程式是______________。
(3)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。
资料:镓的熔点较低(29.8℃),沸点很高(2403℃)。
①传统的氮化镓(GaN)制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式是____________________。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。该可逆反应的热化学方程式是 ____________________________________。
③在密闭容器中,充入一定量的Ga与NH3发生上述反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
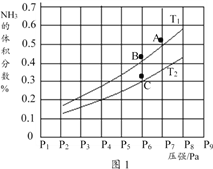
图中A点和C点化学平衡常数的关系是:KA_____ KC (填“>”“=”或“<”),理由是_____________________________。
(4)电解法可以提纯粗镓,具体原理如图2所示:
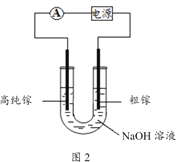
①粗镓与电源____极相连。(填“正”或“负”)
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式是
_____________________________。
-
金属镓有“电子工业脊梁”的美誉,它与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如下图所示:
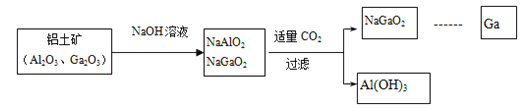
(1)元素Ga位于Al的下一周期,写出镓(Ga)的原子结构示意图为 ____________CO2的电子式为_____________________
(2)下列有关Al、Ga的说法不正确的是______
A.由流程图可知酸性:Al(OH)3>Ga(OH)3 B.Ga2O3可与盐酸反应生成GaCl3
C.Ga(OH)3可由Ga2O3与水反应得到 D.与酸反应的剧烈程度:Al<Ga
(3)图中涉及到的Al、Na、O三种元素简单离子半径由大到小的顺序_____________
(4)步骤二中不能通入过量的CO2,理由_________________(用离子方程式表示)
(5)工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含Zn、Fe、Cu杂质,以NaOH水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为:Zn2+<Ga3+<Fe2+)
①下列有关电解精炼说法正确的是_______
A.阳极发生氧化反应,其主要电极反应式:Ga-3e- ═ Ga3+
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.在阴极除了析出高纯度的镓之外,还有H2产生
D.电解后,电解槽底部的阳极泥中只有Cu和Fe
②阴极析出高纯度镓的电极反应式__________________________________
(6)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。氮化镓(GaN)的一种制备方法是采用GaCl3与NH3在一定条件下反应,写出该反应的化学方程式__________________
-
金属镓有“电子工业脊梁”的美誉,它与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如下图所示:
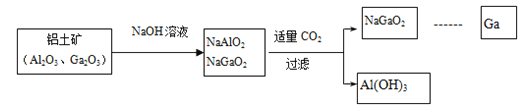
(1)元素Ga位于Al的下一周期,写出镓(Ga)的原子结构示意图为 ____________CO2的电子式为_____________________
(2)下列有关Al、Ga的说法不正确的是______
A.由流程图可知酸性:Al(OH)3>Ga(OH)3 B.Ga2O3可与盐酸反应生成GaCl3
C.Ga(OH)3可由Ga2O3与水反应得到 D.与酸反应的剧烈程度:Al<Ga
(3)图中涉及到的Al、Na、O三种元素简单离子半径由大到小的顺序_____________
(4)步骤二中不能通入过量的CO2,理由_________________(用离子方程式表示)
(5)工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含Zn、Fe、Cu杂质,以NaOH水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为:Zn2+<Ga3+<Fe2+)
①下列有关电解精炼说法正确的是_______
A.阳极发生氧化反应,其主要电极反应式:Ga-3e- ═ Ga3+
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.在阴极除了析出高纯度的镓之外,还有H2产生
D.电解后,电解槽底部的阳极泥中只有Cu和Fe
②阴极析出高纯度镓的电极反应式__________________________________
(6)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。氮化镓(GaN)的一种制备方法是采用GaCl3与NH3在一定条件下反应,写出该反应的化学方程式__________________
-
元素单质及其化合物有广泛的用途,请根据周期表中短周期元素相关知识回答下列问题:
(1)空气中含量最高的元素与第三周期非金属性最强的元素形成的化合物的电子式: ___;
(2)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是____;
a.NH3 b.HI c.SO2 d.CO2
(3)第三周期金属性最强和非金属性最强元素形成的化合物的水溶液通电条件下发生的离子反应方程式:___。
-
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:Si(粗) SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:____。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是____。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:____。
-
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗) SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式___。
(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是___。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:___。






 ,镓元素在周期表中的位置是_______。
,镓元素在周期表中的位置是_______。


