-
下列说法正确的是
A. 二氧化硫可用于杀菌、消毒
B. 煤经过气化和液化等物理变化可转化为清洁能源
C. 氯气和明矾均可做自来水的消毒剂
D. 食品保鲜剂中所含铁粉和生石灰均作还原剂
难度: 简单查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使酚酞变红色的溶液中: Na+、Al3+、SO42-、Cl-
B. 与Al反应能放出H2的溶液中: Fe2+、K+、NO3- 、SO42-
C. Kw/c(H+)=1×10-13 mol·L-1的溶液中: NH4+、Ca2+、Cl-、NO3-
D. 水电离的c(H+)=1×10-13 mol·L-1的溶液中: K+、Na+、AlO2- 、CO32-
难度: 中等查看答案及解析
-
下列化学用语中,正确的是
A. 氯化氢分子的形成过程可用电子式表示为:
B. 16O与 18O的中子数和核外电子排布均不同
C. 稳定性:CH4>SiH4;还原性:HCl>H2S
D. K+、Ca2+、Mg2+的离子半径依次减小
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
难度: 中等查看答案及解析
-
醋酸铅因有甜味而被称为“铅糖”,它有毒但能入药,又知(CH3COO)2Pb可溶于水,硝酸铅与醋酸钠溶液反应的离子方程式为Pb2++2CH3COO-=(CH3COO)2Pb。下列有关说法中不正确的是
A. 0.1 mol·L-1的“铅糖”溶液中c(Pb2+)<0.1 mol·L-1 B. “铅糖”是弱电解质
C. “铅糖”是离子化合物 D. “铅糖”的溶液可能导电性很弱
难度: 中等查看答案及解析
-
已知强酸强碱的稀溶液发生中和反应的热化学方程式:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应,其焓变依次为△H1、△H2、△H3 则它们的关系是
A. △H1>△H2>△H3 B. △H1<△H3<△H2
C. △H1=△H3>△H2 D. △H1>△H3>△H2
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 在恒容下充入惰性气体,容器压强增大,活化分子的百分数不变
B. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
C. NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
D. ΔH<0、ΔS>0的反应在任何温度下都能自发进行
难度: 简单查看答案及解析
-
下列溶液中c(OH-)最小的是
A. 向0.1mol/L氨水中加同体积水
B. 向0.1mol/L KOH溶液中加同体积水
C. 向0.2mol/L KOH溶液中加同体积的0.1mol/L盐酸
D. 向0.2mol/L氨水中加同体积0.1mol/L盐酸
难度: 中等查看答案及解析
-
下列事实不能用电化学理论解释的是( )
A、轮船水线以下的船壳上镶嵌有一定量的锌块
B、镀锌的铁制品比镀锡的铁制品耐用
C、铝片不用特殊方法保存
D、锌跟稀硫酸反应时,滴入少量硫酸铜溶液后,反应速率加快
难度: 简单查看答案及解析
-
pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )

A. X、Y两种碱的物质的量浓度一定相等
B. 稀释后,X溶液碱性比Y溶液碱性强
C. 若9<a<11,则X、Y都是弱碱
D. 完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
难度: 中等查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是
A. 对该反应体系加热 B. 滴加少量CuSO4溶液
C. 向溶液中滴加浓硝酸,以增大氢离子浓度 D. 改用铁粉
难度: 中等查看答案及解析
-
将CoCl2溶解于盐酸中可以形成CoCl42-,在溶液中存在下面的化学平衡:
Co2+(aq)+4Cl-(aq)
CoCl42-(aq) ΔH>0
粉红色 蓝色
下列说法正确的是
A. 升高温度,正反应速率增大,逆反应速率减小
B. 该反应的平衡常数K=c(CoCl42-)/[c(Co2+)c4(Cl-)]
C. 将盛有CoCl2和盐酸混合液的试管置于热水中,试管内溶液为红色
D. 增大Cl-浓度,平衡向正反应方向移动,Co2+、Cl-浓度都减小
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 电解NaCl溶液、熔融态的氯化镁可制得相应的金属单质
B. 工业上可用含Cu2S的矿石和氧化剂O2反应冶炼Cu
C. 铝热反应可用于冶炼高熔点金属,如K、Ca、Cr、Mn等
D. 工业电解熔融态的Al2O3制Al时,加冰晶石的主要作用是提高Al的产量
难度: 中等查看答案及解析
-
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g)
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.提高尾气净化效率的最佳途径是研制高效催化剂
B.提高尾气净化效率的常用方法是升高温度
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
难度: 中等查看答案及解析
-
下表是常温下某些一元弱酸的电离常数:
弱酸
HCN
HF
CH3COOH
HNO2
电离常数
4.9×10-10
7.2×10-4
1.8×10-5
6.4×10-6
则0.1 mol·L-1的下列溶液中,pH最小的是
A. HCN B. HF C. CH3COOH D. HNO2
难度: 简单查看答案及解析
-
K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)
2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )

A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2O72-被C2H5OH还原
C. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 D. 对比②和④可知K2Cr2O7酸性溶液氧化性强
难度: 简单查看答案及解析
-
水的电离平衡曲线如图所示,下列说法不正确的是
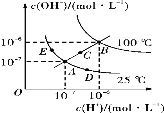
A. 图中五点Kw的关系:B>C>A=D=E
B. 若从A点到E点,可采用温度不变,向水中加入适量的NH4Cl固体
C. 若从A点到D点,可采用温度不变,向水中加入少量的酸
D. 当处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性
难度: 中等查看答案及解析
-
在一密闭容器中,aA(g)
bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则
A. 平衡向正反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增大了 D. a>b
难度: 中等查看答案及解析
-
已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)
N2O4(g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是

A. 平衡时NO2体积分数:甲<乙
B. 达到平衡所需时间,甲与乙相等
C. 该反应的平衡常数表达式K=c(N2O4)/c(NO2)
D. 若两容器内气体的压强保持不变,均说明反应已达到平衡状态
难度: 困难查看答案及解析
-
下列溶液一定呈中性的是
A. pH=7
B. pH=3的盐酸与pH=11的氨水等体积混合后
C. 0.1mol/LNaOH溶液与0.05mol/LH2SO4溶液混合后
D. C(OH-)=
难度: 中等查看答案及解析
