-
常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是
共价键
H—H
F—F
H—F
H—Cl
H—I
E/kJ·mol-1
436
157
568
432
298
A. 432 kJ·mol-1 > E(H—Br) > 298 kJ·mol-1
B. 表中最稳定的共价键是H—F键
C. H2(g)→2H(g) ΔH=+436 kJ·mol-1
D. H2(g)+F2(g) = 2HF(g) ΔH=-25 kJ·mol-1
难度: 中等查看答案及解析
-
25℃和1.01×105Pa,反应2N2O5(g) = 4NO2(g) + O2(g);△H=" +" 56.76 kJ·mol-1能自发进行反应的原因是
A. 是吸热反应
B. 是放热反应
C. 是熵减少的反应
D. 熵增大效应大于能量效应
难度: 简单查看答案及解析
-
下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是

A. 电解水 B. 水力发电 C. 太阳能热水器 D. 干电池
难度: 简单查看答案及解析
-
下列说法正确的是
A. NaCl溶液能导电是因为溶液中有Na+和Cl-
B. CH3COOH与NaOH在相同条件下电离程度相等
C. H2SO4在电流作用下在水中电离出H+和SO42-
D. NaHCO3在溶液中完全电离为Na+、H+和CO32-
难度: 简单查看答案及解析
-
液态化合物AB会发生微弱的自身电离,电离方程式为AB
A++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是
A. c(A+)随温度的升高而降低 B. 35 ℃时,c(A+)>c(B-)
C. AB的电离程度:α(25 ℃)>α(35 ℃) D. AB的电离是吸热过程
难度: 中等查看答案及解析
-
雪是冬之精灵,在雪
水
冰的转化中能量变化的叙述正确的是
A. ΔH1>0,ΔH2>0 B. ΔH1<0,ΔH2<0
C. ΔH1>0,ΔH2<0 D. ΔH1<0,ΔH2>0
难度: 简单查看答案及解析
-
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是
A. N5+中含有36个电子 B. O2与O4属于同分异构体
C. C60和12C、14C互为同位素 D. H2与H3属于同素异形体
难度: 中等查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
A. 加入催化剂可加快该反应的速率,从而提高SO2的转化率
B. 增大反应体系的压强,反应速率一定增大
C. 该反应是放热反应,故温度越低,对提高SO3的日产量越有利
D. 在2min时间内,SO2的浓度由6 mol/L变为3 mol/L,则在相同时间段内,SO3(g)生成的平均速率为1.5 mol/(L·min)
难度: 中等查看答案及解析
-
在一密闭容器中,等物质的量的A和B发生反应:A(g)+2B(g)
2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
A. 40% B. 50% C. 60% D. 70%
难度: 中等查看答案及解析
-
在一定温度下,体积不变的密闭容器中,可逆反应X(g)+3Y(g)⇌2Z(g)达到平衡的标志是
A. 气体总质量保持不变 B. 消耗Z的速率是生成X的速率的2倍
C. X、Y、Z的浓度不再发生变化 D. X、Y、Z的分子数之比为1:3:2
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生气体11.2 L
B. 常温常压下,92 g的NO2和N2O4混合气体中含有的原子数为6NA
C. 0. 25 mol Na2O2中含有的阴离子数为0.5NA
D. 在反应KIO3+6HI = KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
难度: 中等查看答案及解析
-
已知反应3A(g)+B(g)
C(s)+4D(g) △H﹤0,如图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是:①增大B的浓度 ②升高反应温度 ③缩小反应容器的体积(加压) ④加入催化剂
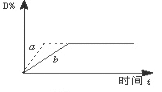
A. ①② B. ①③ C. ③④ D. ②③
难度: 中等查看答案及解析
-
X、Y、Z是中学化学常见的三种有色物质(其组成元素均属于短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂。下列说法正确的是
A. X、Y、Z中,只有Y能使湿润的淀粉-碘化钾试纸变蓝
B. 1 mol Y或Z与足量水完全反应时,均转移2 mol电子
C. Z为离子化合物,但含有非极性键,阴、阳离子个数比为1 : 2
D. X和Y均能用向上排空气法和排水法收集
难度: 中等查看答案及解析
-
在相同温度时,100 mL 0.01 mol/L的醋酸溶液与10mL 0.l mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A. 中和时所需NaOH的量 B. OH-的物质的量浓度
C. 与Mg反应的起始速率 D. 溶液中
难度: 中等查看答案及解析
-
对于反应N2(g)+3H2(g)
2NH3(g) △H<0.达到平衡后,以下分析正确的是
A. 增大压强,对正反应的反应速率影响更大
B. 升高温度,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
难度: 中等查看答案及解析
-
下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l
B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(Cl-)+c(H+)=c(NH4+)+c(OH-)
C. 常温下0.1 mol·L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol·L-l
D. 常温下向10 mL0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,
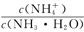 将减小
将减小难度: 困难查看答案及解析
-
在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
难度: 简单查看答案及解析
-
在体积固定的密闭容器中加入2mol A和1mol B,发生反应:2A(g)+B(g)
3C(g)+D(g),达到平衡时C的浓度为a mol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol/L的是
A. 4 mol A+2 mol B B. 2 mol A+1 mol B+1 mol He
C. 3 mol C+2 mol D D. 2 mol A+1 mol D
难度: 中等查看答案及解析
-
可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是
A. 电池工作时,电子通过外电路从正极流向负极
B. 以NaOH溶液为电解质时,负极反应为Al+3OH--3e-==Al(OH)3↓
C. 以NaOH溶液为电解质时,电池在工作过程中电解质溶液的pH保持不变
D. 以NaCl溶液或NaOH溶液为电解质时,正极反应都为O2+2H2O+4e-== 4OH-
难度: 中等查看答案及解析
-
在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通入Y气体,发生反应:X(s)+aY(g)
bZ(g)+W(g);△H>0,平衡时Z的物质的量与通入Y的物质的量的变化关系如图所示。下列说法中正确的是
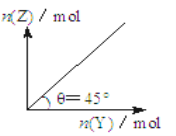
A. 平衡时Y的转化率为(b/a)×100%
B. 向容器中再加入少量X,则Y的转化率增大
C. 再通入Y,重新达到平衡时W的体积分数不变
D. 保持压强一定,当原反应在较高温度下建立平衡时,图中θ<45°
难度: 中等查看答案及解析
-
25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中
的关系如图所示。下列说法正确的是
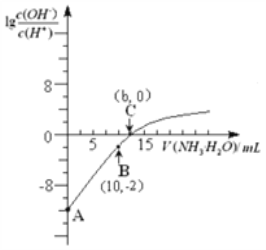
A. H2A的电离方程式为H2A
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为
难度: 困难查看答案及解析
-
室温下,关于浓度均为0.1mol•L﹣1的盐酸和醋酸溶液,下列说法不正确的是
A. 分别加水稀释10倍后,醋酸的pH大
B. 两者分别与形状大小完全相同的Zn发生反应,开始时盐酸中反应速率快
C. 等体积的两溶液分别与相同浓度的NaOH溶液反应至中性,盐酸消耗的NaOH溶液体积大
D. 等体积的两种溶液分别与足量的Zn发生反应,醋酸中产生的H2多
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
A. 原子半径的大小顺序为W>Q>Z>X>Y
B. 元素X的气态氢化物与Q的单质可发生置换反应
C. 元素X与Y可以形成5种以上的化合物
D. 元素Q的最高价氧化物对应水化物的酸性比W的强
难度: 简单查看答案及解析
-
用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A. AgNO3 CuCl2 Cu(NO3)2 B. KCl Na2SO4 CuSO4
C. CaCl2 KOH NaNO3 D. HCl HNO3 K2SO4
难度: 中等查看答案及解析
-
下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛。下列说法中正确的是
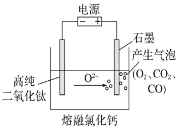
A. 阳极的电极反应式为2Cl--2e-===Cl2↑ B. 阴极的电极反应式为TiO2+4e-===Ti+2O2-
C. 通电后,O2-、Cl-均向阴极移动 D. 石墨电极的质量不发生变化
难度: 中等查看答案及解析
-
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A. 加入适量6 mol·L-1的盐酸 B. 加入少量醋酸钠固体
C. 加热 D. 加入少量金属钠
难度: 中等查看答案及解析
-
某温度时,发生反应2HI(g)
H2(g)+I2(g),向三个体积相等的恒容密闭容器A、B、C中,分别加入①2mol HI;②3mol HI;③1mol H2与1mo1I2,分别达平衡时,以下关系正确的是
A. 平衡时,各容器的压强:②=①=③
B. 平衡时,I2的浓度:②>①=③
C. 平衡时,I2的体积分数:②>①=③
D. 从反应开始到达平衡的时间:①>②=③
难度: 困难查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:下列说法不正确的是
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
A. 反应前2min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前:v(逆)<v(正)
C. 该温度下此反应的平衡常数:K=1.44
D. 保持其他条件不变,起始时向容器充入0.32 mol气体X和0.32 mol气体Y,到达平衡时,c(Z)=0.024 mol/L
难度: 中等查看答案及解析
-
浓度均为0.1 mol/L、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随
的变化关系如图所示。下列叙述正确的是
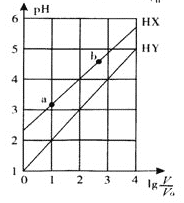
A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 常温下,由水电离出的c(H+)·c(OH-):a<b
C. 相同温度下,电离常数K( HX):a>b
D.
=3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则
减小
难度: 困难查看答案及解析
-
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)
COS(g)+H2(g) K=0.1反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应 B. CO的平衡转化率为80%
C. 反应前H2S物质的量为7 mol D. 通入CO后,正反应速率逐渐增大
难度: 中等查看答案及解析
 。
。