-
“五千年文化,三千年诗韵。我们的经典从未断流”,明代诗人于谦在《石灰吟》中写道:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。”这首脍炙人口的诗篇不仅蕴含了深刻的人文精神,还蕴藏了有趣的化学知识,下列有关说法中,错误的是
A. 化学反应过程中同时存在着物质变化和能量变化,其中物质变化是基础
B. 这首诗说明化学能与热能在一定条件下可以相互转化
C. 石灰石的分解是熵增反应,因此在任何条件下都能自发进行
D. “要留清白在人间”涉及反应中的化学物质有强电解质、弱电解质和非电解质`
难度: 中等查看答案及解析
-
下列说法正确的是
A. 小苏打是弱电解质,其水溶液导电能力很弱
B. 硫酸是强电解质,在水溶液和熔融状态下均能导电
C. 氯气是非电解质,但氯水能导电
D. 甲酸是弱电解质,加水稀释会促进甲酸分子的电离
难度: 中等查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。(提示:原子利用率=目标生成物的质量/参加反应的所有反应物的质量×100%),下列说法正确的是
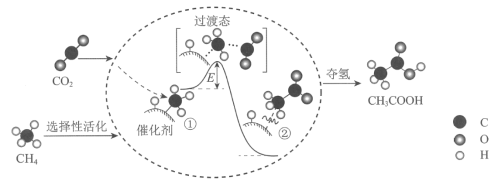
A. ①→②吸收能量并形成了C―C键
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. 该催化剂可有效提高反应物的平衡转化率
D. 生成CH3COOH总反应的原子利用率小于100%
难度: 中等查看答案及解析
-
下列关于判断过程的方向的说法正确的是
A. 所有自发进行的化学反应都是放热反应
B. 熵减小的化学反应不能自发进行
C. 有气体生成的反应一定是熵增大的反应
D. “冰,水为之,而寒于水”,水结冰过程中△H < 0 ,△S < 0
难度: 中等查看答案及解析
-
一定量的铁片与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是
A. 加入NaHSO4固体,产生H2速率不变,H2体积不变
B. 加入CH3COOK固体,产生H2速率减小,H2体积减小
C. 滴加少量CuSO4溶液,产生H2速率变大,H2体积不变
D. 加入少量水,产生H2速率减小,H2体积不变
难度: 中等查看答案及解析
-
一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH=-906 kJ·mol-1,下列叙述正确的是
A. 2 mol NH3和5 mol O2充分反应,达到平衡时放出热量为453 kJ
B. 平衡时5v正(O2)=4v逆(NO)
C. 平衡后降低温度,混合气体中NH3含量减小
D. 平衡后减小压强,混合气体平均摩尔质量增大
难度: 中等查看答案及解析
-
将BaO2放入密闭真空容器中,反应2BaO2(s)
2BaO(s)+O2(g)达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡不同
A. 保持体积不变,升高温度 B. 保持温度不变,缩小容器的体积
C. 保持体积和温度不变,充入一定量的氧气 D. 保持体积和温度不变,加入BaO2
难度: 中等查看答案及解析
-
不能用于判断HA是弱电解质(弱酸)的依据是
A. 浓度相等的HCl与HA两溶液,比较c(H+) :HCl约是HA的100倍
B. pH相等的HCl与HA两溶液,c(HA)约是c(HCl)的100倍
C. 浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
D. pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
难度: 中等查看答案及解析
-
下列说法正确的是
A. H2S溶于水的电离方程式为H2S
2H++S2-,向H2S溶液中加入少量CuCl2固体,电离平衡正向移动
B. KHSO4在熔融状态下的电离方程式为KHSO4 = K++H++SO42-,向醋酸中加入少量KHSO4固体,电离平衡逆向移动
C. 向稀氨水中滴加少量2mol/LNH4NO3,溶液,NH4+与OH- 结合生成NH3·H2O,使平衡正向移动,电离常数增大
D. 常温下,冰醋酸加水稀释的过程中,溶液的导电能力先增大后减小
难度: 中等查看答案及解析
-
氢氰酸(HCN)是一种剧毒类弱酸,具有苦杏仁气味,将其加水不断稀释,下列各量始终保持增大的是
A. Ka(HCN) B. c(H+) C. c(CN-)/c(HCN) D. C(HCN)/ c(H+)
难度: 中等查看答案及解析
-
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g)
N2(g)+O2(g)K1=1×1030
2H2(g)+O2(g)
2H2O(g)K2=2×1081
2CO2(g)
2CO(g)+O2(g)K3=4×10-92
以下说法正确的是
A. 常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B. 常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C. 常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D. 以上说法都不正确
难度: 简单查看答案及解析
-
下列实验过程不能达到实验目的的是
编号
实验目的
实验过程
A
探究浓度对平衡的影响
各取2mL0.1mol/L的重铬酸钾溶液于两支试管中,分别加入5~15滴浓硫酸和5~15滴6mol/L氢氧化钠溶液, 记录溶液颜色的变化
B
探究温度对平衡的影响
将两份等浓度含有少量酚酞的氨水分别置于冰水浴和40℃热水浴中(忽略NH3的挥发),记录溶液颜色的
变化
C
制取并纯化氯气
向高锰酸钾固体中滴加浓盐酸,将产生的气体依次通过饱和食盐水、浓硫酸的洗气瓶
D
证明催化效果Fe3+>Cu2+
向2支盛有2 mL相同温度,相同浓度H2O2溶液的试管中同时加入5滴氯化铁溶液和硫酸铜溶液,观察实验现象
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某温度下,将2 mol SO2和1 mol O2置于容积为10 L的密闭容器中发生反应2SO2(g)+O2(g)
2SO3(g) ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
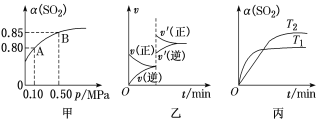
A. 由图甲推断,A点对应温度下该反应的平衡常数为800
B. 由图甲推断,B点O2的平衡浓度为0.15 mol·L-1
C. 达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D. 压强为0.50 MPa时,不同温度下SO2的转化率与温度的关系如图丙所示,则T2>T1
难度: 中等查看答案及解析
-
反应 N2O4(g)
2NO2(g)在温度为 T1、T2(T2>T1)时,平衡体系中 NO2的体积分数随压强变化如下图所示.下列说法正确的是
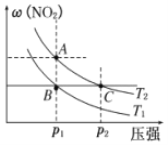
A. 由图可知 B 点的平衡常数大于 C 点的平衡常数
B. A、C 两点气体的颜色:A 深,C 浅
C. A、C 两点气体的平均相对分子质量:A < C
D. 保持容器体积不变,再充入 N2O4气体,N2O4的转化率增大
难度: 中等查看答案及解析
-
在一定温度下,反应HX(g)
1/2H2(g)+ 1/2X2(g) 的平衡常数为0.1。若将等物质的量的H2(g)和X2(g)通入体积为1L的密闭容器中,在该温度下HX(g)的最大产率接近于( )
A. 83% B. 17% C. 5% D. 33%
难度: 中等查看答案及解析
-
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应PCl5(g)
PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
t / s
0
50
150
250
350
n(PCl3) / mol
0
0. 16
0. 19
0. 20
0. 20
A. 反应在前50 s 的平均速率ν(Cl2)= 0. 0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)= 0. 13 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2 ,反应达到平衡前ν(正)<ν(逆)
D. 相同温度下,起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2 ,达到平衡时,PCl3 的转化率大于80%
难度: 中等查看答案及解析