-
以下几个热化学方程式,能表示有关物质燃烧时的燃烧热的热化学方程式是( )
A. C(s)+1/2O2(g)===CO(g) ΔH=+110.5 kJ·mol-1
B. C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D. H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
难度: 中等查看答案及解析
-
已知一定温度和压强下2H2(g)+O2(g)=2H2O(g) ΔH1=-a kJ·mol-1,下列叙述不正确的是( )
A. 2 mol H2(g)和1 mol O2(g)完全反应生成2 mol H2O(g)时放出a kJ的热量
B. 2 mol H2O(g)完全分解为2 mol H2(g)和1 mol O2(g)时吸收a kJ的热量
C. 2 mol H2(g)和1 mol O2(g)完全反应生成2 mol H2O(l)时放出的热量小于a kJ
D. 1 mol H2(g)和0.5 mol O2(g)完全反应生成1 mol H2O(g)时放出0.5a kJ的热量
难度: 简单查看答案及解析
-
下列有关化学能与热能的说法正确的是( )
A. 铝热反应属于吸热反应
B. 若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应
C. H2→H+H的变化需要吸收能量
D. 凡经加热而发生的化学反应都是吸热反应
难度: 中等查看答案及解析
-
已知:2C(s)+O2(g)= 2CO(g) ΔH=-217 kJ·mol-1,C(s)+H2O(g)=CO(g)+H2(g) ΔH=b kJ·mol-1,H—H、O—H和O=O键的键能分别为436 kJ·mol-1、462 kJ·mol-1和495 kJ·mol-1,则b为( )
A. +352 B. +132 C. -120 D. -330
难度: 简单查看答案及解析
-
已知:①CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-a kJ/mol
②CO(g)+1/2 O2(g)= CO2(g) ΔH=-b kJ/mol
③H2(g)+1/2 O2(g)= H2O(g) ΔH=-c kJ/mol
④H2(g)+1/2 O2(g)= H2O(l) ΔH=-d kJ/mol
下列叙述不正确的是( )
A. 由上述热化学方程式可知d>c
B. H2的燃烧热为d kJ/mol
C. CH3OH(g)= CO(g)+2H2(g) ΔH=(b+2c-a)kJ/mol
D. 当CO和H2的物质的量之比为1∶2,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为Q/(b+2c)mol
难度: 中等查看答案及解析
-
已知强酸与强碱在稀溶液里反应的中和热可表示为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,对下列反应:CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ·mol-11/2,H2SO4(浓)+NaOH(aq)===1/2 Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1,HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-Q3 kJ·mol-1,上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是( )
A. Q2>Q3>Q1 B. Q2>Q1>Q3 C. Q1=Q2=Q3 D. Q2=Q3>Q1
难度: 中等查看答案及解析
-
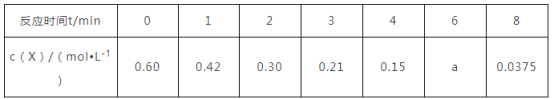
在容积为2 L的密闭容器内合成氨,已知在时间t内,氨的物质的量增加了0.6 mol,在此时间段内,用氢气表示的平均反应速率是0.45 mol·L-1·s-1,则t是( )
A. 0.44 s B. 1 s C. 1.33 s D. 2 s
难度: 简单查看答案及解析
-
为探究锌与稀硫酸的反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是 ( )
A. 加入NH4HSO4固体,v(H2)不变 B. 加入少量水,v(H2)减小
C. 加入CH3COONa固体,v(H2)增大 D. 滴加少量CuSO4溶液,v(H2)减小
难度: 简单查看答案及解析
-
一定温度下反应N2+O2
2NO在密闭容器中进行,下列措施不改变化学反应速率的是
A. 缩小体积使压强增大 B. 恒容,充入N2
C. 恒容,充入He D. 恒压,充入He
难度: 中等查看答案及解析
-
化学平衡一定发生移动的是( )
A. 化学反应速率发生了改变
B. 有气态物质参加的可逆反应达到平衡后,改变了压强
C. 由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D. 可逆反应达到平衡后,使用催化剂
难度: 简单查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14 mol·L-1
难度: 中等查看答案及解析
-
下列关于N2(g)+3H2(g)
2NH3(g) ΔH<0,反应速率与时间的关系图中,纵坐标为反应速率v,横坐标为时间t,当反应达到平衡后,条件发生改变与速率变化的关系中不符合实际的是( )
A. 恒容恒压升高温度
 B. 恒温、恒压压缩体积
B. 恒温、恒压压缩体积 C. 加入催化剂
C. 加入催化剂 D. 补充氮气和氢气分离氨气
D. 补充氮气和氢气分离氨气
难度: 中等查看答案及解析
-
在容积不变的密闭容器中,一定条件下进行反应:NO(g)+CO(g)=1/2N2(g)+CO2(g) ΔH=-373.2 kJ/mol。如图曲线a表示该反应过程中,NO的转化率与反应时间的关系,若改变起始条件,使反应过程按照曲线b进行,可采取的措施是( )
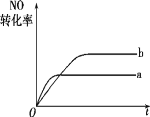
A. 加催化剂 B. 向密闭容器中加入氩气
C. 降低温度 D. 增大反应物中NO的浓度
难度: 中等查看答案及解析
-
在密闭容中发生下列反应aA(g)
cC(g)+dD(g),压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a<c+d
难度: 中等查看答案及解析
-
一定条件下,将3 mol A和1 mol B两种气体混合于容积为2 L的密闭容器中,发生反应:3A(g)+B(g)
xC(g)+2D(s)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol/L。下列判断正确的是( )
A. 该条件下此反应的平衡常数约为0.91
B. 2 min内A的平均反应速率为0.3 mol/(L·s)
C. B的转化率为60%
D. 混合气体的密度不再改变时,该反应不一定达到平衡状态
难度: 中等查看答案及解析
-
已知某化学反应的平衡常数表达式为K=c(CO2) c(H2)/(CO) c(H2O),在不同的温度下该反应的平衡常数值分别为:
下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态
D. 某温度下,如果平衡浓度符合下列关系式: c(CO2)/3(CO)=c(H2O)/5 c(H2),判断此时的温度1000℃
难度: 中等查看答案及解析
-
FeCl3溶液与KSCN溶液混合时存在下列平衡:Fe3+(aq)+SCN-(aq)
[Fe(SCN)]2+(aq)。已知某一条件下,反应达到平衡时,[Fe(SCN)]2+的物质的量浓度与温度的关系如图所示,下列说法正确的是( )
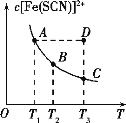
A. 该反应为吸热反应
B. T1、T2时反应的平衡常数分别为K1、K2,则K1>K2
C. 反应处于D点时,一定有v正>v逆
D. A点的c(Fe3+)比B点的c(Fe3+)大
难度: 中等查看答案及解析
-
根据表中数据(均在同温、同压下测定):

可得出弱电解质强弱顺序正确的是( )
A. HX>HY>HZ B. HZ>HY>HX C. HY>HZ>HX D. HZ>HX>HY
难度: 简单查看答案及解析
-
一只规格为a mL的滴定管,其尖嘴部分充满溶液,管内液面在m mL处,当液面降到n mL处时,下列判断正确的是( )
A. 流出溶液的体积为(m-n) mL B. 流出溶液的体积为(n-m) mL
C. 管内溶液体积等于(a-n) mL D. 管内溶液体积多于n mL
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 加水稀释0.01 mol·L-1的CH3COOH溶液,溶液中c(OH-)减小
B. 室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C. 氨水加水稀释后,溶液中c(NH3·H2O)/c(NH4+)的值增大
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
难度: 中等查看答案及解析
-
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A. 相同浓度的两溶液中c(H+)相同
B. 100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠
C. pH=3的两溶液稀释至原体积的100倍后,pH都为5
D. 相同浓度时导电能力醋酸强
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. c(H+)>c(OH-)的溶液一定显酸性
B. 常温下,pH=6的溶液一定是酸溶液
C. 电解稀硫酸或氢氧化钠溶液的产物不同
D. 将纯水加热,其KW增大而pH不变
难度: 中等查看答案及解析
-
25 ℃,某稀溶液中由水电离产生的c(H+)为1×10-10 mol·L-1,下列说法正确的是( )
A. 该溶液的pH不可能是7 B. 该溶液不可能存在
C. 该溶液的pH一定是10 D. 该溶液的pH一定是4
难度: 中等查看答案及解析
-
现有pH=5的CH3COOH溶液10 mL,要使pH增大3,可采取的方法有( )
A. 向溶液中加水稀释至10 L B. 加入一定量的NaOH固体
C. 加入一定量pH=8的NaOH溶液 D. 加入一定浓度的盐酸
难度: 中等查看答案及解析
-
用0.1mol/L NaOH溶液滴定0.lmol/L盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL).继续加水至50mL,所得溶液的pH是
A. 4 B. 7.2 C. 10 D. 11.3
难度: 简单查看答案及解析