-
下列说法正确的是( )
A. 铜、石墨均能导电,所以它们均是电解质
B. NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C. 液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
D. 蔗糖、酒精在水溶液或熔融状态下均不能导电,所以它们均是非电解质
难度: 简单查看答案及解析
-
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是
A. 制造过程中元素种类没有改变 B. CCl4是一种化合物
C. 这个反应是氧化还原反应 D. 金刚石属于金属单质
难度: 简单查看答案及解析
-
下列实验装置与实验目的对应的是( )


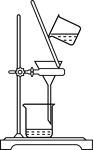

A.用海水制蒸馏水
B.将碘水中的碘单质与水直接分离
C.除去Fe(OH)3胶体中的FeCl3
D.稀释浓硫酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
有一无色未知溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强.某学生还要鉴定此溶液中是否大量存在①Cu2+ ②Al3+ ③Cl﹣ ④NO3﹣ ⑤NH4+ ⑥CO32﹣⑦Na+ ⑧Mg2+ ⑨Fe3+,而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是
A. ③⑤⑥⑨ B. ①③⑥⑨ C. ③④⑦⑧⑨ D. ①②⑨
难度: 简单查看答案及解析
-
在甲、乙两个体积不同的密闭容器中,分别充入质量相同的CO、CO2气体时,两容器的温度和压强均相同,则下列说法正确的是
A. 充入的CO分子数比CO2分子数少 B. 甲容器的体积比乙容器的体积小
C. 甲中CO的密度比乙中CO2的密度小 D. CO的摩尔体积比CO2的摩尔体积小
难度: 简单查看答案及解析
-
下列化学变化中,需加入氧化剂才能实现的是
A. CuO→Cu B. C→CO2 C. H2SO4→BaSO4 D. CO2→CO
难度: 简单查看答案及解析
-
实验过程中,下列溶液的导电能力变化不大的是
A. Ba(OH)2溶液中滴入H2SO4溶液至过量
B. 醋酸溶液中滴入氨水至过量
C. NH4Cl溶液中加入适量的NaOH固体
D. 澄清石灰水中通入CO2至过量
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列判断正确的是
A. 常温常压下,22.4L O2含有的分子数目为NA
B. 34.0 g H2S含有的氢原子数目为NA
C. 25℃,1.01×105Pa,44g CO2中含有的原子数为3NA
D. 1.00mol·L-1 Ba(NO3)2 溶液中含有的NO3-离子数目为2NA
难度: 简单查看答案及解析
-
某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是
A. 定容时,仰视凹液面最低点
B. 有少量NaOH溶液残留在烧杯里
C. 向容量瓶中加水未到刻度线
D. 用带游码的托盘天平称2.4g NaOH时误用了“左码右物”方法
难度: 简单查看答案及解析
-
实验是解决化学问题的基本途径,下列有关实验的叙述不正确的是
A. 240 mL 0.2 mol·L-1 的NaCl溶液配制:需要使用天平、250 mL容量瓶等仪器
B. 向FeCl3稀溶液中滴加NaOH溶液,并加热煮沸,可制备Fe(OH)3胶体
C. 将10 mL 18.4 mol·L-1 浓硫酸加水稀释至1 L,稀释后溶液中H2SO4的物质的量浓度为0.184 mol·L-1
D. 用苯萃取碘水中的碘时,萃取后的油层不能从分液漏斗下端放出
难度: 简单查看答案及解析
-
我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被还原
难度: 中等查看答案及解析
-
“钴酞菁(分子直径1.3×10–9m)”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似,我国科学家在世界上第一次为“钴酞菁”分子恢复了磁性。下列关于“钴酞菁”的说法正确的是
A.在水中形成的分散系属于悬浊液
B.在水中形成的分散系属于胶体
C.分子直径比Na+小
D.“钴酞菁”分子既能透过滤纸,也能透过半透膜
难度: 简单查看答案及解析
-
下列离子反应方程式正确的是
A. NaHCO3溶液与NaOH溶液反应:HCO3-+OH- =CO32-+H2O
B. 硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
C. 醋酸与氢氧化钠溶液反应:H++OH-=H2O
D. 盐酸与CaCO3反应:CO32-+2H+=H2O+CO2↑
难度: 简单查看答案及解析
-
已知:X2、Y2、Z2、W2四种物质的氧化性由强到弱的顺序是W2>Z2>X2>Y2,下列氧化还原反应能够发生的是
A. 2NaW+Z2=2NaZ+W2 B. 2NaY+W2=2NaW+Y2.
C. 2NaZ+X2=2NaX+Z2 D. 2NaX+Y2=2NaY+X2
难度: 简单查看答案及解析
-
某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl﹣的物质的量为
A. adw/12 mol B. dw/(24a) mol C. adw/24000 mol D. adw/24 mol
难度: 简单查看答案及解析
-
已知反应:
①Cl2+2KBr=2KCl+Br2;
②KClO3+6HCl=3Cl2+KCl+3H2O;
③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 反应②中氧化剂与还原剂的物质的量之比为1:6
C. 氧化性由强到弱顺序为 KClO3>KBrO3>Cl2>Br2
D. ③中lmol还原剂反应则失去电子的物质的量为10mol
难度: 简单查看答案及解析