-
下列物质与危险化学品标志的对应关系错误的是
A
B
C
D




砒霜
KCl
乙醇
浓NaOH溶液
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
溶液、浊液、胶体的本质区别是
A. 能否产生丁达尔现象 B. 能否透过半透膜
C. 是否是均一、稳定的 D. 分散质粒子半径大小
难度: 简单查看答案及解析
-
规范的实验操作是实验安全的基础,下列实验操作合理的是
A. 给试管中的固体加热时,试管口斜向上45度,且不能对着人
B. 用氢气还原氧化铜时,先通一会儿氢气,然后再点燃酒精灯加热
C. 实验结束,将废液倒入下水道排出实验室,以免污染实验室
D. 用燃着的酒精灯去点燃另一盏酒精灯
难度: 简单查看答案及解析
-
下列实验操作中正确的是
A. 萃取操作时,选择的萃取剂密度必须比水大
B. 分液操作时,分液漏斗里上、下层液体均从下口放出
C. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
D. 蒸发操作时,使混合物中的水分完全蒸干后才停止加热
难度: 简单查看答案及解析
-
下列物质的电离方程式书写正确的是
A. Na2CO3 = Na2+ + CO32−
B. NaHCO3 = Na+ + H+ + CO32−
C. H2CO3 = 2H+ + CO32−
D. Ba(OH)2 = Ba2+ + 2OH−
难度: 简单查看答案及解析
-
下列玻璃仪器可以用于直接加热的是
A. 烧杯 B. 试管
C. 蒸馏烧瓶 D. 容量瓶
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是
A. NA的单位是摩尔
B. 标准状况下,22.4 L氦气所含的原子数为2NA
C. 1.7 g H2O2中含有的电子数为0.9 NA
D. 1 mol·L-1 NaCl溶液含有NA个Na+
难度: 简单查看答案及解析
-
常温下,下列物质中原子数最多的是
A. 64 g SO2 B. 3.01×1023个N2
C. 0.75 mol H2S D. 36 mL H2O
难度: 简单查看答案及解析
-
下列实验事故的处理方式不恰当的是
A. 实验时手不慎被玻璃划伤,先取出伤口中的碎玻璃片再用双氧水清洗,然后敷药包扎
B. 酒精灯着火了用湿毛巾盖灭
C. 将CO中毒者移至通风处抢救
D. 不慎将NaOH溶液粘在皮肤上,先用大量水冲洗,再涂上盐酸
难度: 简单查看答案及解析
-
在加入石蕊试液呈蓝色的溶液中,下列能够大量共存的离子组是
A. H+、SO42-、CO32-、Na+
B. Ag+、K+、Ca2+、NO3-
C. K+、Ba2+、Cl-、NO3-
D. Mg2+、K+、HCO3-、Cl-
难度: 简单查看答案及解析
-
下列说法正确的是
A. 1 mol H2O中含有2 mol氢和1 mol氧
B. 6.02×1023个某气体分子在标准状况下的体积约是22.4 L
C. 同温同压下,等体积的氧气和二氧化碳所含分子数均为NA
D. 1 mol任何物质溶于水配成1 L溶液,所得溶液中溶质物质的量浓度一定为1 mol·L-1
难度: 中等查看答案及解析
-
当光束通过下列分散系时,能产生丁达尔效应的是
A. CuSO4溶液 B. 早上清新的空气
C. 自来水 D. Fe(OH)3沉淀
难度: 简单查看答案及解析
-
下列能达到实验目的的是
A.
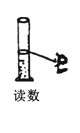 B.
B. 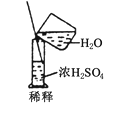
C.
 D.
D. 
难度: 简单查看答案及解析
-
下列说法正确的是
A. 由同种元素组成的物质一定是纯净物
B. 氨水导电,所以氨水是电解质
C. 能电离出H+的化合物都是酸
D. 硫酸钡是一种难溶于水的强电解质
难度: 简单查看答案及解析
-
将2 mol·L-1NaCl溶液和3 mol·L-1CaCl2溶液等体积混合后,溶液中Na+、Ca2+、Cl-的物质的量之比为
A. 2:3:8 B. 2:3:6 C. 3:2:6 D. 2:3:3
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 分散系有的是纯净物,有的是混合物
B. “冰水混合物”不是一种分散系
C. 直径介于1~100 nm之间的微粒称为胶体
D. 胶体很不稳定,极易发生聚沉
难度: 简单查看答案及解析
-
下列给定条件下的离子反应方程式书写正确的是
A. 浓盐酸与铁片反应:2Fe + 6H+= 2Fe3+ + 3H2↑
B. 稀硫酸与Ba(OH)2溶液反应:H++ SO42- + Ba2+ + OH-= BaSO4↓+ H2O
C. 小苏打与NaOH溶液混合:HCO3- + OH-= CO32- + H2O
D. 氧化铜粉末溶于浓盐酸:2H+ + O2-= H2O
难度: 简单查看答案及解析
-
下列物质的分类正确的组合是
纯净物
电解质
强电解质
非电解质
碱性氧化物
A
盐酸
H2SO4
HNO3
干冰
SO3
B
蒸馏水
KCl
苛性钠
SO2
Na2O
C
CuSO4·5H2O
氯气
Na2CO3
BaSO4
生石灰
D
Fe
氨水
石灰石
酒精
过氧化钠
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于2 mol·L-1 Ba(NO3)2溶液的说法正确的是
A. 100 mL溶液中NO3- 浓度是0.4 mol·L-1
B. 500 mL溶液中NO3- 的物质的量是4 mol
C. 500 mL溶液中含有Ba2+ 的质量是137 g
D. 100 mL溶液中所含Ba2+、NO3-总数为0.4 NA
难度: 简单查看答案及解析
-
某溶液经分析,其中只含有Na+、K+、Ca2+、Cl−、NO3-,已知其中Na+、K+、Ca2+、NO3-的浓度均为0.1mol⋅L−1,则Cl−的物质的量浓度为
A. 0.1mol⋅L−1 B. 0.3mol⋅L−1 C. 0.2mol⋅L−1 D. 0.4mol⋅L−1
难度: 中等查看答案及解析
-
某地无色透明水样中可能大量存在以下离子中的一种或几种:H+、Na+、Ba2+、Mg2+、Cu2+、Cl-、CO32-、OH-,某化学兴趣小组为了测定其成分做了如下实验:向水样中滴入石蕊试液,溶液变成蓝色;另取一份水样,向其中滴入过量的稀盐酸,产生大量气泡。由此可以得出水样中
A. 一定没有H+、Mg2+、CO32-、Cu2+
B. 可能存在Cl-、Na+、Mg2+,一定不存在Cu2+
C. 一定存在H+、Na+、OH-
D. 一定存在Na+、CO32-、OH-,可能存在Cl-
难度: 简单查看答案及解析
-
VmL Fe2(SO4)3溶液中含有Fe3+mg,取2V/3 mL该溶液用水稀释至4VmL,则SO42-物质的量浓度为
A. 125m/28V mol·L-1 B. 125m/9V mol·L-1
C. 125m/56V mol·L-1 D. 125m/18V mol·L-1
难度: 简单查看答案及解析
 _________________________________
_________________________________