-
下列热化学方程式中的反应热又为燃烧热的是
A. CO(g)+1/2O2(g)=CO2(g) △H= - 283.0kJ/mol
B. CH4(g)+3/2O2(g)=CO(g)+2H2O(l)△H= - 607.3kJ/mol
C. H2(g)+1/2O2(g)=H2O(g)△H= - 241.8kJ/mol
D. H+(aq)+OH-=H2O(l)△H= - 57.3kJ/mol
难度: 中等查看答案及解析
-
下列说法中有错误的是
A. 升高温度,一般可使活化分子的百分数增大,因而反应速率增大
B. 加入适宜的催化剂,可使活化分子的百分数大大增加,从而增大反应速率
C. 活化分子之间发生的碰撞一定为有效碰撞
D. 对有气体参加的反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,反应速率增大
难度: 中等查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是
A. 水的离子积变大、pH变小、呈酸性 B. 水的离子积变大、pH变小、呈中性
C. 水的离子积变小、pH变大、呈碱性 D. 水的离了积不变、pH变小、呈中性
难度: 中等查看答案及解析
-
在2A(g)+B(g)
3C(g)+4D(g)中,表示该反应速率最快的是
A. υ(A)=0.5 mol/(L•s) B. υ(D)=60 mol/(L•min)
C. υ(C)=0.8 mol/(L•s) D. υ(B)=0.3 mol/(L•s)
难度: 简单查看答案及解析
-
下面是一段关于酸碱中和实验操作的叙述:①取一锥形瓶,用待测NaOH溶液润洗两次。②在一锥形瓶中加入25 mL待测NaOH溶液。③加入几滴酚酞试剂做指示剂。④取一支酸式滴定管,洗涤干净。⑤直接往酸式滴定管中注入标准酸溶液,进行滴定。⑥左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶。⑦两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点。文中所述操作有错误的序号为
A. ④⑥⑦ B. ①⑤⑥⑦ C. ①⑤⑦ D. ①③⑤⑦
难度: 中等查看答案及解析
-
“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得产物,即原子的利用率为100%.在用丙炔合成甲基丙烯酸甲酯
的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是
A. CH2=CH2和CO B. CO和CH3OH C. CH3OH和H2 D. CO2和H2O
难度: 中等查看答案及解析
-
在0.1 mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡下列叙述正确的是
A. 加入水时,平衡逆向移动
B. 加入少量NaOH固体,平衡正向移动
C. 加入少量0.1 mol/L 盐酸,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡正向移动
难度: 中等查看答案及解析
-
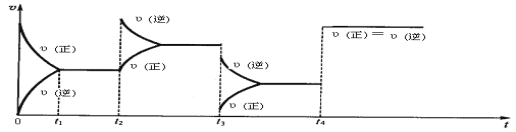
如图是某条件下N2与H2反应过程中能量变化的曲线图。根据图像判断下列叙述中正确的是
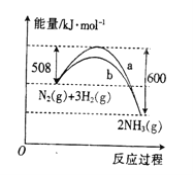
A. 该反应的热化学方程式为
B. a曲线是加入催化剂时的能量变化曲线
C. 反应
D. 加入催化剂,该化学反应的反应热数值会减小
难度: 中等查看答案及解析
-
室温下,如图为用一定物质的量浓度的NaOH溶液Y滴定10 mL一定物质的量浓度的盐酸X的图象,依据图象推出X和Y的物质的量浓度是下表内各组中的

A
B
C
D
X/mol·L-1
0.12
0.09
0.04
0.03
Y/mol·L-1
0.04
0.03
0.12
0.09
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对可逆反应4NH3(g) + 5O2(g)
4NO(g) + 6H2O(g),下列叙述正确的是
A. 化学反应速率关系是:2v正(NH3) = 3v正(H2O)
B. .若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 达到化学平衡时,4v正(O2) = 5v逆(NO)
难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)
2Z(g)+W(s) ΔH >0,下列叙述正确的是
A. 加入少量W,逆反应速率增大
B. 升高温度,正反应速率增大,逆反应速率减小 ,平衡正向移动。
C. 当容器中气体压强不变时,反应达到平衡
D. 平衡后加入X,上述反应的ΔH不变
难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是
A. 相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2
B. 由C(石墨)→C(金刚石) ΔH=+1.9kJ/mol ,可知金刚石比石墨稳定
C. 在稀溶液中,H+ (aq)+ OH-(aq) =H2O(l) ΔH =-57.3 kJ/mol,若将含0.5 mol硫酸的浓硫酸与含1 molNaOH的溶液混合,放出的热量大于57.3 kJ
D. 已知在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量。则有关氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH =+285.8kJ/mol
难度: 中等查看答案及解析
-
对于可逆反应2AB3(g)
2A(g) + 3B2(g) ΔH>0 下列图象不正确的是
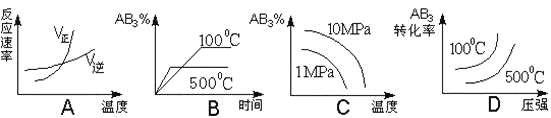
难度: 中等查看答案及解析
-
在298K、1.01×105 Pa下,将22g CO2缓慢通入750mL 1 mol•L-1NaOH溶液中充分反应后,测得反应放热为x kJ.已知该条件下,1mol CO2缓慢通入1L 2 mol•L-1NaOH溶液中充分反应后放热为y kJ.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
A. CO2 (g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJ•mol-1
B. 2CO2 (g)+2NaOH(aq)=2NaHCO3(aq) △H=-(8x-y) kJ•mol-1
C. CO2 (g)+NaOH(aq)=NaHCO3(aq) △H=-(2x-y) kJ•mol-1
D. CO2 (g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y) kJ•mol-1
难度: 中等查看答案及解析
-
将 4mol A气体和 2mol B气体在 2L 固定体积的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g).若经2s后测得 C 的浓度为 0.6 mol•L-1,现有下列几种说法,其中正确的是
A. 用物质A表示的反应的平均速率为0.2 mol•L-1•s-1 B. 2s时物质B的浓度为0.7 mol•L-1
C. 用物质B表示的反应的平均速率为0.1 mol•L-1•s-1 D. 2s时物质A的转化率为70%
难度: 中等查看答案及解析
-
向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g)
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A. 0.5molCO+2molH2O(g)+1molCO2+1molH2
B. 1molCO+1molH2O(g)+1molCO2+1molH2.
C. 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D. 0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
难度: 中等查看答案及解析
-
已知一定温度下,X(g)+2Y(g)
mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是
A. a=b B. 2a<c C. m<3 D. m>3
难度: 中等查看答案及解析
-
改变0.1
二元弱酸
溶液的pH,溶液中的
、
、
的物质的量分数
随pH的变化如图所示[已知
]。
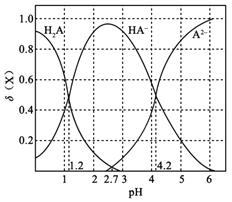
下列叙述错误的是
A. pH=1.2时,
B.
C. pH=2.7时,
D. pH=4.2时,
难度: 困难查看答案及解析